Virus de l’encéphalite à tique (TBEV) : Mise en évidence de cas humains en France liés à une contamination alimentaire, point sur le cycle de transmission de cette maladie et situation en Europe. Mise à jour au 28/09/2020
Version initiale : 03/07/2020
Dates des précédentes mises à jour : 15/07/2020
Les parties mises à jour sont grisées
Virus de l’encéphalite à tique (TBEV) : Mise en évidence de cas humains en France liés à une contamination alimentaire, point sur le cycle de transmission de cette maladie et situation en Europe
- Un virus transmis à l’être humain essentiellement par piqûre de tiques.
- De rares cas de transmission à l’être humain via la consommation de produits laitiers crus.
- Première identification de cas liés à ce type de transmission en France en avril 2020.
- Un cycle de transmission impliquant de nombreuses espèces animales réservoirs.
- Une maladie rare en France.
Cécile Beck1, Sylvie Lecollinet1, Sandrine Lacour1, Sara Moutailler2, Laure Bournez3, Sandra Martin-Latil4, Isabelle Leparc-Goffart5
Auteur correspondant : cecile.beck@anses.fr
- Anses, Laboratoire de santé animale, UMR1161 Virologie, INRAE, Anses, ENVA, Maisons-Alfort, France
- Anses, Laboratoire de santé animale, UMR BIPAR, Anses, INRAE, ENVA, Maisons-Alfort, France
- Anses, Laboratoire de la rage et de la fauve sauvage, unité SEEpiAS, Nancy, France
- Anses, Laboratoire de sécurité des aliments, unité des virus entéritiques, Maisons-Alfort, France
- IRBA, CNR arbovirus, Marseille, France
Contexte
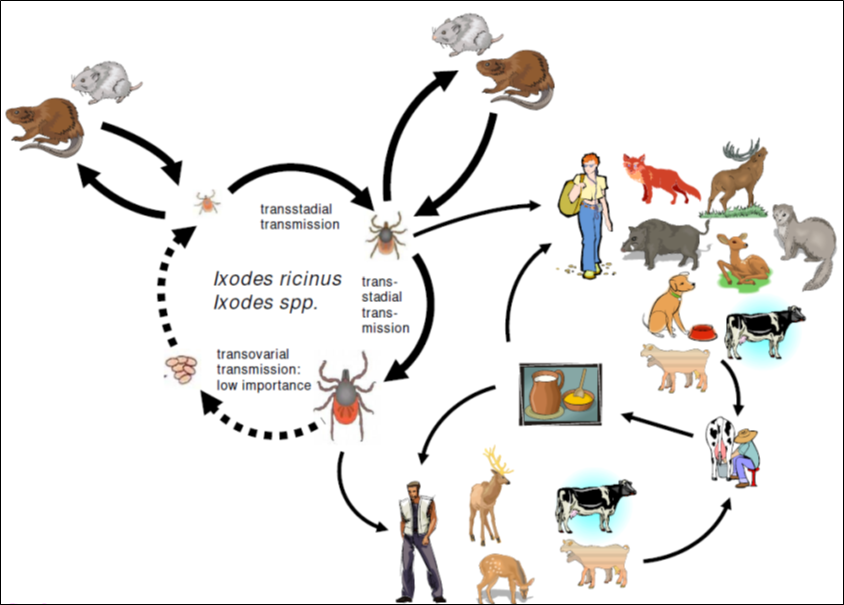
Le TBEV (tick-borne encephalitis virus) ou virus de l’encéphalite à tique est un agent pathogène viral transmis par les tiques qui est présent en Asie, en Extrême Orient et en Europe. Plusieurs milliers de cas humains d’encéphalites à tique sont enregistrés en Europe chaque année (cf Encadré 1 et 2). Le cycle de transmission du virus est détaillé en Encadré 2.
Il existe trois sous-types de TBEV : le sous-type occidental ou européen (TBEV-Eu), le sous-type sibérien (TBEV-Si) et le sous-type Extrême-Orient (Far Eastern) (TBEV-FE). Ces trois sous-types circulent en Europe avec le TBEV-Si et le TBEV-FE récemment détectés dans les pays baltes et à l’Est de la Finlande (4, 5). En Europe de l’Ouest dont la France, seul le sous-type européen a été détecté jusqu’à présent. Il est généralement considéré comme moins pathogène avec 20 à 30 % des personnes infectées qui développent des symptômes cliniques et de 20 à 30 % de celles-ci qui présentent des signes méningés et des troubles neurologiques (2). En France, une vingtaine de cas sont diagnostiqués par an, essentiellement en Alsace et en Haute-Savoie mais aussi plus récemment en Loire et Haute-Loire. Les contaminations étaient jusqu’à présent uniquement liées à des piqûres de tiques en rapport avec les activités de loisirs et professionnelles dans les zones boisées humides (1, 2) (cf Encadré 1).
Premiers cas humains en France liés à une contamination alimentaire
Des premiers cas de méningites lymphocytaires d'étiologie non identifiée sont survenus à partir du 14 avril 2020 dans l’Ain avec un pic de cas la semaine suivante. Au 22 juin, 44 cas d’encéphalite à tiques (EAT) ou de formes atténuées pseudo-grippales, avaient été recensés, dans un rayon de 30 km. Pour 33 d’entre eux, le diagnostic d'infection par TBEV a été confirmé par le Centre National de Référence (CNR) des Arbovirus. Les onze autres cas sont en cours d’investigation (Source : santé publique france au 22/06/2020)
Quarante et un des 43 cas (95 %) ont rapporté avoir consommé du fromage ou de la faisselle à base de lait cru de chèvre en provenance d'un même producteur. Le génome du TBEV a été mis en évidence par le CNR dans un lot de fromages de ce producteur et par l’Anses dans du lait cru de chèvres, confirmant la cause alimentaire de ces infections.
Des investigations dans des élevages de chèvres sont en cours et font intervenir une équipe pluridisciplinaire impliquant le laboratoire de santé animale site de Maisons-Alfort (unités de virologie et de parasitologie (BIPAR)), le laboratoire de la rage et de la faune sauvage de Nancy (unité SEEpiAS), le laboratoire de sécurité des aliments (unité des Virus Entériques), le CNR et la Direction Départementale de la Protection des Populations (DDPP). Ces investigations complémentaires visent à appuyer les services vétérinaires dans le contrôle de l’infection et la gestion du troupeau (voir encadré 3). Ainsi, la prévalence de l’infection (présence des anticorps anti-TBEV dans le sang) et la proportion de chèvres excrétant le virus dans le lait sont mesurées en concertation avec l’éleveur, la DDPP et la Direction générale de l’Alimentation (DGAL). Des premières analyses ont permis de détecter du génome de TBEV dans le lait de tank regroupant la production laitière du troupeau de chèvre.
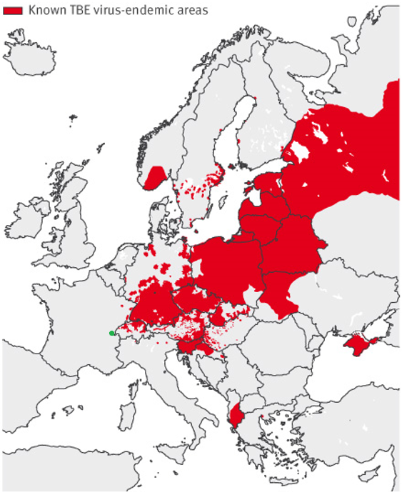
| Encadré 1 : Situation en France et au niveau européen L’encéphalite à tique est une préoccupation croissante en Europe avec plusieurs milliers de cas humains d’encéphalites à tique enregistrés en Europe chaque année (3 212 cas en 2018, ECDC au 18/12/2019), avec toutefois des variations importantes des déclarations suivant les années. Endémique dans de nombreux pays européens (Lituanie, Lettonie, république Tchèque, Slovénie…), on observe une augmentation du nombre de cas chez l’homme comme en Suisse (niveau record d’infection à TBEV en 2018 avec 377 cas déclarés et au premier semestre 2020 en comparaison du premier semestre 2018 et 2019) (14, Promed au 14/07/2020/Promed) corrélée à une extension de l’aire de répartition du virus à de nouvelles zones géographiques (Pays-Bas, Danemark, Norvège et Angleterre) (15-18, ECDC au 18/12/2019) (figure 1). En Allemagne, une recrudescence de la présence de tiques adultes a été constatée lors de captures menées en mai 2020. C’est la troisième année consécutive que des chiffres élevés sont observés sur une période d’étude couvrant les neuf dernières années. Les chercheurs allemands concluent à une augmentation du risque de contamination de l’Homme (Source :
Promed au 27/06/2020). Cette abondance de tiques a effectivement été associée à un nombre plus élevé d’infections (535 cas) qu’en 2018 (469 cas), année record pour les cas humains d’infection par le virus de l’encéphalite à tique en Allemagne (Source : Promed au 24/09/2020). La France représente la limite de distribution la plus à l’ouest du TBEV en Europe. Le nombre de cas par année y est relativement stable avec 2 à 29 cas par an (3, 19). L’encéphalite à tique est présente particulièrement en Alsace et en Lorraine (incidence de 1,33 cas/100 000 habitants en 2016) (3) mais des cas sporadiques humains ont été détectés dans les Alpes (Annecy) depuis 2003 (2, 3) et en Auvergne Rhône Alpes durant les étés 2017-2018 (20). De plus, on peut suspecter que l’aire de répartition du virus est beaucoup plus étendue que celle estimée à partir des cas humains, avec des sérologies trouvées positives contre TBEV chez des professionnels forestiers ainsi que chez des sangliers et chevreuils dans d’autres régions de l’Est de la France comme la Bourgogne, Franche-Comté, Champagne-Ardenne et Savoie (19, 21).
|
|
Encadré 2 : Cycle de transmission
|
Encadré 3 : Enquêtes réalisées en élevage
L’absence de signes cliniques chez les ruminants empêche une surveillance événementielle en élevage (21). Il n’y a pas de surveillance programmée réalisée dans les élevages. Seules des enquêtes sérologiques ponctuelles basées sur des analyses individuelles sur sérum ou sur l’analyse de prélèvements de lait et s’inscrivant dans des programmes de recherche ont été mises en œuvre dans plusieurs pays européens.
Ces enquêtes permettent de définir les zones à risque pour la transmission du TBEV, en complément de la surveillance et de la déclaration des cas humains d’infection et d’un éventuel screening des tiques vectrices (22). A titre d’exemple, en Suède, des échantillons de lait et de colostrum ont été prélevés sur des ovins et des caprins et analysés par ELISA pour détecter la présence d'anticorps anti-TBEV (suivi d’une validation par Western Blot et de la détermination des titres neutralisants). Cela a permis d'identifier trois nouveaux foyers (23). En Roumanie, où le cheptel ovin représente 11 % de la production ovine à l’échelle européenne, des anticorps dirigés contre le TBEV ont été retrouvés dans le sérum de 15,02 % des ovins échantillonnés dans 50 localités de cinq départements situés au Nord-Ouest de la Roumanie (24).
Ces enquêtes permettent également de souligner la complémentarité des approches de diagnostic direct et indirect. En Norvège, 112 échantillons de lait (diagnostic direct par RT-PCR) et de sang (sérologie avec ELISA et séroneutralisation de confirmation) ont été prélevés sur des vaches provenant de cinq exploitations différentes réparties du sud au nord du pays. Des animaux étaient infectés depuis peu et excrétaient du virus dans le lait dans trois exploitations, alors qu’une seule exploitation détenait des animaux sérologiquement positifs et négatifs en RT-qPCR (25).
En Pologne, un total de 119 échantillons de lait non pasteurisé prélevés sur des vaches, chèvres et brebis de huit exploitations situées dans une zone à risque ont été testés. La présence d'ARN du virus a été recherchée par RT-qPCR et celle des anticorps anti-TBEV par ELISA. Le génome du TBEV a été trouvé dans le lait de brebis (22 %), suivi du lait de chèvre (21 %) et de vache (11 %). Les anticorps anti-TBEV ont été le plus fréquemment trouvés dans le lait de brebis (15 %). Ils ont été également mis en évidence dans du lait de vache (3 %) mais pas dans le lait de chèvre (26).
Références bibliographiques
1. Thorin C, Rigaud E, Capek I, André-Fontaine G, Oster B, Gastinger G, et al. Séroprévalence de la borréliose de Lyme et de l’encéphalite à tiques chez des professionnels exposés dans le Grand Est de la France. Medecine et maladies infectieuses. 2008;38(10):533-42.
2. Velay A, Argemi X, Wendling M-J, Martinot M, Hansmann Y, Fafi-Kremer S. L’encéphalite à tique en France : qu’en savons-nous aujourd’hui ? Revue Francophone des Laboratoires. 2019;2019(513):34-43.
3. Velay A, Solis M, Kack-Kack W, Gantner P, Maquart M, Martinot M, et al. A new hot spot for tick-borne encephalitis (TBE): A marked increase of TBE cases in France in 2016. Ticks and tick-borne diseases. 2018;9(1):120-5.
4. Suss J. Tick-borne encephalitis 2010: epidemiology, risk areas, and virus strains in Europe and Asia-an overview. Ticks and tick-borne diseases. 2011;2(1):2-15.
5. Jaaskelainen AE, Sironen T, Murueva GB, Subbotina N, Alekseev AN, Castren J, et al. Tick-borne encephalitis virus in ticks in Finland, Russian Karelia and Buryatia. The Journal of general virology. 2010;91(Pt 11):2706-12.
6. Hubalek Z, Rudolf I. Tick-borne viruses in Europe. Parasitology research. 2012;111(1):9-36.
7. Labuda M, Jones LD, Williams T, Nuttall PA. Enhancement of tick-borne encephalitis virus transmission by tick salivary gland extracts. Medical and veterinary entomology. 1993;7(2):193-6.
8. Dumpis U, Crook D, Oksi J. Tick-borne encephalitis. Clinical Infectious Diseases. 1999;28(4):882-90.
9. Brockmann SO, Oehme R, Buckenmaier T, Beer M, Jeffery-Smith A, Spannenkrebs M, et al. A cluster of two human cases of tick-borne encephalitis (TBE) transmitted by unpasteurised goat milk and cheese in Germany, May 2016. Euro surveillance : bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin. 2018;23(15).
10. Gresikova M. Recovery of the tick-borne encephalitis virus from the blood and milk of subcutaneously infected sheep. Acta virologica. 1958;2(2):113-9.
11. Klaus C, Ziegler U, Hoffmann D, Press F, Fast C, Beer M. Tick-borne encephalitis virus (TBEV) antibodies in animal sera - occurrence in goat flocks in Germany, longevity and ability to recall immunological information after more than six years. BMC veterinary research. 2019;15(1):399.
12. Holzmann H, Aberle SW, Stiasny K, Werner P, Mischak A, Zainer B, et al. Tick-borne encephalitis from eating goat cheese in a mountain region of Austria. Emerging infectious diseases. 2009;15(10):1671-3.
13. Pfeffer M, Dobler G. Emergence of zoonotic arboviruses by animal trade and migration. Parasites & vectors. 2010;3(1):35.
14. OFSP. https://www.bag.admin.ch/bag/fr/home/das-bag/aktuell/news/news-04-02-2019.html. Consulté le 08 Juin 2020.
15. Agergaard CN, Rosenstierne MW, Bødker R, Rasmussen M, Andersen PHS, Fomsgaard A. New tick-borne encephalitis virus hot spot in Northern Zealand, Denmark, October 2019. Euro surveillance : bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin. 2019;24(43).
16. Holding M, Dowall SD, Medlock JM, Carter DP, McGinley L, Curran-French M, et al. Detection of new endemic focus of tick-borne encephalitis virus (TBEV), Hampshire/Dorset border, England, September 2019. Euro surveillance : bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin. 2019;24(47).
17. Holding M, Dowall SD, Medlock JM, Carter DP, Pullan ST, Lewis J, et al. Tick-Borne Encephalitis Virus, United Kingdom. Emerging infectious diseases. 2020;26(1):90-6.
18. Dekker M, Laverman GD, de Vries A, Reimerink J, Geeraedts F. Emergence of tick-borne encephalitis (TBE) in the Netherlands. Ticks and tick-borne diseases. 2019;10(1):176-9.
19. Bournez L, Umhang G, Faure E, Boucher JM, Boué F, Jourdain E, et al. Exposure of Wild Ungulates to the Usutu and Tick-Borne Encephalitis Viruses in France in 2009-2014: Evidence of Undetected Flavivirus Circulation a Decade Ago. Viruses. 2019;12(1).
20. Botelho-Nevers E, Gagneux-Brunon A, Velay A, Guerbois-Galla M, Grard G, Bretagne C, et al. Tick-Borne Encephalitis in Auvergne-Rhône-Alpes Region, France, 2017-2018. Emerging infectious diseases. 2019;25(10):1944-8.
21. Valarcher JF, Hägglund S, Juremalm M, Blomqvist G, Renström L, Zohari S, Leijon M, Chirico J. Tick-borne encephalitis. Rev Sci Tech. 2015;34(2):453-66.
22. Alfano N, Tagliapietra V, Rosso F, Ziegler U, Arnoldi D, Rizzoli A. Tick-borne encephalitis foci in northeast Italy revealed by combined virus detection in ticks, serosurvey on goats and human cases. Emerg Microbes Infect. 2020 26;9(1):474-484.
23. Wallenhammar A, Lindqvist R, Asghar N, Gunaltay S, Fredlund H, Davidsson Å, et al. Revealing new tick-borne encephalitis virus foci by screening antibodies in sheep milk. Parasites & vectors. 2020;13(1):185.
24. Salat J, Mihalca AD, Mihaiu M, Modrý D, Ruzek D. Tick-Borne Encephalitis in Sheep, Romania. Emerg Infect Dis. 2017;23(12):2065-2067.
25. Paulsen KM, Stuen S, das Neves CG, Suhel F, Gurung D, Soleng A, et al. Tick-borne encephalitis virus in cows and unpasteurized cow milk from Norway. Zoonoses and public health. 2019;66(2):216-22.
26. Cisak E, Wójcik-Fatla A, Zając V, Sroka J, Buczek A, Dutkiewicz J. Prevalence of tick-borne encephalitis virus (TBEV) in samples of raw milk taken randomly from cows, goats and sheep in eastern Poland. Ann Agric Environ Med. 2010;17(2):283‑6.