Epizootie de diarrhée épidémique porcine aux USA : le point sur l’émergence d’une maladie aujourd’hui absente en Europe
Ahead of print
Nicolas Rose1, Marie-Frédérique Le Potier1
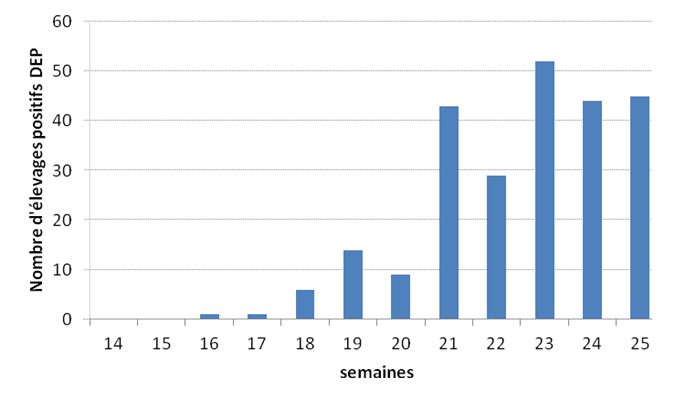
Fin avril 2013, les premiers cas de diarrhée épidémique porcine (DEP) (ou PED pour Porcine Epidemic diarrhea en anglais) ont été détectés aux Etats-Unis alors que cette maladie n’avait jamais été décrite auparavant sur le continent américain. Aujourd’hui, plus de 200 sites porcins ont été infectés (Figure 1), la majorité d’entre eux se trouvant dans les États à forte concentration porcine : Iowa, Minnesota, Indiana principalement et récemment en Oklahoma (60 cas depuis le mois de juin). Quelques cas ont été décrits en Ohio, Colorado, Missouri, Illinois, Michigan, Nebraska et Dakota du sud. Le coronavirus responsable de cette maladie, proche de celui de la gastro-entérite transmissible (GET), n’avait jamais été détecté aux Etats-Unis jusqu’ici. Ce virus touche les porcs de tous âges, mais entraîne principalement de la mortalité chez les porcelets avant sevrage (jusqu’à 95%). La maladie est par ailleurs enzootique dans de nombreux pays d’Asie orientale.
Figure 1: incidence hebdomadaire du nombre d’élevages confirmés DEP positif aux Etats-Unis depuis le mois d’avril 2013 (semaine 14) (source : AASV)
Agent étiologique
Le virus de la DEP est un coronavirus, classé dans le genre Alphacoronavirus avec le virus de la GET et celui du coronavirus respiratoire porcin (CVRP) (différent de celui du SARS (betacoronavirus)). Il s’agit d’un virus à ARN positif enveloppé de 28kb, peu résistant dans le milieu extérieur. Il ne se conserve pas non plus dans les viandes de porc et ne se transmet pas à l’Homme. Ce virus, difficile à cultiver sur cellules, se transmet par voie oro-fécale entre porcs. Des formes plus virulentes ont été décrites en 2011 et 2012 en Chine. Par analyse moléculaire basée sur les séquences des gènes codant pour les protéines S, M et ORF3, il est possible d’identifier différents clusters selon la région d’origine. Les isolats chinois sont très proches des coréens mais différents génétiquement des souches européennes comme des souches vaccinales (Song and Park, 2012).
Diagnostic
Sur le plan clinique le virus de la DEP est responsable d’une diarrhée profuse, aqueuse pouvant toucher différentes classes d’âges (animaux adultes, porcelets sous la mère, porcs en croissance). Des vomissements peuvent aussi être observés sur les porcelets ou même les truies. Au pic de l’épizootie, le taux de morbidité peut atteindre 100% et le taux de mortalité est souvent très élevé chez les porcelets sous la mère (50% en moyenne, pouvant atteindre 100%). La situation post-épizootie évolue souvent sous une forme enzootique avec persistance de diarrhées chez les porcs en croissance d’âge supérieur. Il est très difficile de différencier la DEP de la GET sur le plan clinique. Pour confirmer un cas de DEP et notamment le différencier d’une infection par le virus de la GET, l’approche classique est de combiner une détection directe de l’antigène ou du virus, associée à une réponse sérologique. Les échantillons biologiques pour la recherche du virus sont les fèces ou les cellules épithéliales du petit intestin prélevé chez le jeune porcelet 24 h après le début de diarrhée aiguë. Le virus peut être mis en évidence par microscopie électronique dans les fèces par sa morphologie caractéristique et identifié par agrégation avec des antisérums spécifiques de porcs convalescents. Toutefois, la visualisation et l’identification des particules virales nécessitent une expertise technique peu disponible en Europe vu que ce type d’affection a disparu depuis plus de vingt ans. L’isolement viral sur culture cellulaire est difficile mais possible sur cellules Vero ou PK15. La RT-PCR reste la méthode la plus sensible et la plus spécifique, en routine en Corée et au Japon (Kim et al., 2001). La détection d’anticorps spécifiques peut se faire par IPMA (immunoperoxidase monolayer assay) ou ELISA (Saif et al., 2012).
Epidémiologie
La description des premiers cas de DEP remonte au début des années 1970 en Angleterre (Oldham, 1972) où une maladie proche de la GET a été observée dans plusieurs élevages. La différence clinique avec la GET portait sur l’absence de maladie chez les porcelets sous la mère. Le coronavirus de la GET et d’autres agents infectieux à tropisme entérique ont été exclus et la maladie dénommée alors « diarrhée épidémique virale » s’est étendue à plusieurs pays en Europe. Par la suite, d’autres épisodes, pour lesquels la GET a également été exclue mais où les porcelets sous la mère étaient aussi touchés, ont été décrits. Ce n’est qu’en 1978 qu’un coronavirus a été identifié en tant qu’agent de ce nouveau syndrome appelé “Diarrhée épidémique porcine” (DEP) (Chasey and Cartwright, 1978 ; Pensaert and DeBouck, 1978). Dans les années 1980, des enquêtes sérologiques conduites dans plusieurs pays européens (Belgique, Angleterre, Allemagne, France, Pays-Bas, Suisse, Bulgarie) ont montré la très large diffusion du virus dans la population porcine. A partir des années 1990 la plupart des travaux montrent que la prévalence du virus tend à décliner dans ces pays (Pensaert and Van Reeth, 1998) avec cependant quelques cas sporadiques jusqu'à la fin des années 1990. Les cas décrits en Europe dans les années 1990 contrastaient avec ceux de certains pays d’Asie où l’on observait plutôt des épidémies sévères associées à de très fort taux de mortalité (Japon, Corée). Depuis la maladie n’est plus décrite en Europe à l’exception de l’épidémie de diarrhée qui a affecté des porcs de tous âges en Italie de mai 2005 à juin 2006. L’infection par le virus de la DEP a été confirmée dans 63 élevages par microscopie électronique, RT-PCR et sérologie. Dans les élevages naisseurs, les truies et les porcelets étaient atteints de diarrhée profuse sans mucus ni sang. A l’aide d’un suivi longitudinal détaillé d’un élevage de 2 500 truies naisseur-post-sevreur, les auteurs rapportent un taux de mortalité moyen en lien avec la diarrhée chez les nouveaux nés de 11,9%, atteignant 34% au pic de l’épizootie dans l’élevage. A la fin de l’épizootie, le taux de mortalité en lien avec la diarrhée est resté supérieur à ce qu’il était avant l’épisode. Dans les élevages post-sevreurs et engraisseurs, la morbidité pouvait atteindre de 20 à 80% mais la mortalité était quasi nulle. La durée de l’épisode clinique était très variable selon le type et la taille de l’élevage, de quelques semaines à plusieurs mois (Martelli et al., 2008). Aujourd’hui, la situation en Asie revêt plus la forme d’une enzootie associée à une population de truies partiellement immune favorisant ponctuellement l’émergence d’épizooties locales.
La voie de transmission oro-fécale est probablement prépondérante, si ce n’est la seule voie de propagation de l’infection au sein d’une population. Les épisodes cliniques aigus documentés montrent que l’épizootie au sein d’un élevage sensible survient quatre à cinq jours après l’introduction ou la vente de porcs. Le virus est ainsi probablement introduit en élevage via des porcs infectés ou par des vecteurs mécaniques (bottes, camions, etc.), soulignant l’importance des mesures de biosécurité et d’hygiène dans la prévention de l’introduction du virus de la DEP en élevage. Le processus de transmission diffère ainsi peu du virus de la GET mais le virus de la DEP est susceptible de persister plus facilement sous une forme enzootique au sein de l’élevage après une première phase épizootique. Un cycle enzootique peut ainsi s’instaurer dans les élevages où le rythme de rotation est important et s’accompagne de mélanges de portées de bandes différentes et de statut immunitaire hétérogène. Il convient de rappeler que le virus n’est pas zoonotique et qu’il n’existe pas de risque de transmission à l’Homme par l’alimentation ou par l’exposition à des porcs infectés.
Situation actuelle aux Etats-Unis
Le virus de DEP incriminé aux Etats-Unis est une souche très virulente à l’origine d’une diarrhée aqueuse intense sur les porcs de tous âges accompagnée parfois de vomissements et conduisant jusqu’à 100% de mortalité sur les porcelets sous la mère. Les autres catégories d’animaux sont affectées, mais moins sévèrement que les jeunes porcelets. L’origine de la contamination du cas index n’a toujours pas été identifiée. Les enquêtes rétrospectives conduites montrent que le premier cas identifié remonte à la mi-avril et il s’agit d’un site d’engraissement situé dans l’Ohio. L’épizootie s’est propagée très rapidement à plus de 200 sites porcins en quelques mois. Les données disponibles sur le site de l’AASV (American Association of Swine Veterinarians) montrent un incidence qui reste élevée la semaine 25 (Figure 1). Les services vétérinaires et les professionnels se sont organisés pour identifier la source d’introduction en menant des investigations détaillées dans les élevages touchés avec l’aide des praticiens porcins. Le virus a été séquencé et présente plus de 99% d’identité avec le génome d’un virus de DEP isolé en Chine en 2012. Dans la mesure où ces virus mutent rapidement, ceci semble indiquer une introduction sur le territoire américain relativement récente. Les pays voisins tels que le Canada ont mis en place une communication importante vers les professionnels de la filière porcine du pays destinée à renforcer de manière drastique les mesures de biosécurité en élevage. Les professionnels de la filière porcine aux Etats-Unis ont débloqué en urgence 450 000 $ pour des travaux de recherche sur cette problématique (informations disponibles sur le site du National Pork Board).
L’Europe n’est pas à l’abri d’une introduction du virus dont les conséquences sont difficiles à évaluer. Les structures des élevages et des mouvements d’animaux au sein de la filière porcine française sont très différentes de celles des USA. Néanmoins, une vigilance des acteurs du terrain s’avère nécessaire afin de détecter le plus précocement possible une introduction dans la population porcine française et mettre en place des mesures rapides de limitation de la propagation à d’autres élevages.
1 : Anses – laboratoire de Ploufragan-Plouzané, France
Références
Chasey, D., Cartwright, S.F., 1978. Virus-like particles associated with porcine epidemic diarrhea. Res. Vet. Sci., 25:255-256.
Kim, S.Y., Song, D.S., and Park, B.K., 2001. Differential detection of transmissible gastroenteritis virus and porcine epidemic diarrhea virus by duplex RT-PCR. J. Vet. Diagn. Invest. 13:516–520.
Martelli, P., Lavazza, A., Nigrelli, AD., Merialdi, G., Alborali, L.G., Pensaert, M.B., 2008. Epidemic of diarrhoea caused by porcine epidemic diarrhoea virus in Italy. Vet. Rec. 162:307–310.
Oldham, J., 1972. Pig Farming (Oct suppl), 72-73.
Pensaert, M.B., DeBouck, P., 1978. A new coronavirus-like particle associated with diarrhea in swine. Arch. Virol., 58:243-247.
Pensaert, M.B., Van Reeth, K., 1998. Porcine epidemic diarrhea and porcine respiratory coronavirus. Proceedings of the American Association of Swine Practitioners, 433-436.
Saif, L., Pensaert, M.B., Sestak, K., Yeo, S.G., and Jung, K., 2012. Coronaviruses. Diseases of swine, 10th edition. Edited by Zimmerman J, Karriker LA, Ramirez A, Scwartz KJ, Stevenson GW. 501-524.
Song, D. and Park, B., 2012. Porcine epidemic diarrhea virus: a comprehensive review of molecular epidemiology, diagnosis and vaccines. Virus Genes, 44:167-175.