Extension géographique de l’acarien exotique Tropilaelaps spp., parasite des abeilles : Bilan de la situation au niveau international fin 2024
Pour le Laboratoire National de Référence sur la Santé des Abeilles1 : Stéphanie Franco, Marion Laurent, Véronique Duquesne.
Pour le comité de rédaction VSI de la Plateforme ESA (par ordre alphabétique) : Julien Cauchard, Céline Dupuy, Guillaume Gerbier, Sophie Molia, Carlène Trévennec
Pour la DGAl : Jean-François Ravisé, Cédric Sourdeau
Auteur correspondant : plateforme-esa@anses.fr ; lnr.abeille@anses.fr
- Anses, Unité Pathologie de l’Abeille, Sophia Antipolis, France
Cette note fait un état des lieux fin 2024 de l’extension géographique internationale de l’acarien Tropilaelaps spp., parasite des abeilles réglementé au niveau communautaire et national.
Les acariens du genre Tropilaelaps sont des parasites externes des abeilles, originaires d’Asie. Ils se reproduisent et se nourrissent dans le couvain sur les larves et nymphes d’abeilles, engendrant des affaiblissements, des désertions de ruches, des mortalités de colonies et des pertes potentiellement importantes de production. Tropilaelaps étant dépendant du couvain d’abeilles pour son alimentation, sa durée de survie sur les abeilles adultes et dans les matrices apicoles (ex : pollen, gelée royale, miel, cadre de ruche) est courte (de l’ordre de 3 à 6 jours) (Franco et Duquesne 2024).
Quatre espèces de Tropilaelaps ont été décrites : T. clareae, T. koenigerum, T. mercedesae et T. thaï. A l’origine, chacune de ces espèces tend à être associée à une abeille géante asiatique, comme Apis dorsata, Apis laboriosa et Apis breviligula. A l’heure actuelle, seules T. mercedesae et T. clareae sont décrites chez Apis mellifera, l’abeille à miel d’origine européenne. Ces acariens se sont adaptés à ce nouvel hôte, chez qui ils peuvent se reproduire et assurer leurs cycles parasitaires (de Guzman et al. 2017).
Au niveau international, l’infestation par Tropilaelaps spp. fait partie de la liste des maladies de l’Organisation mondiale pour la santé animale (OMSA) pour les abeilles mellifères (source : OMSA). Les Etats membres de l’OMSA sont tenus de fournir des informations sur leur situation sanitaire via le système WAHIS.
L’Union européenne (UE), indemne de cette parasitose exotique, réglemente cette maladie pour les abeilles du genre Apis. L’infestation par Tropilaelaps spp est en effet classée en catégories D et E dans la loi de Santé Animale[1]. Elle est soumise à notification obligatoire.
En France, la surveillance de Tropilaelaps repose sur :
- Un dispositif évènementiel, basé sur la déclaration de toute suspicion ;
- Un dispositif programmé dans le cadre des importations de reines de pays tiers (inspection obligatoire des lots de reines importés à leur arrivée dans l’Union européenne) et dans le cadre des échanges intracommunautaires, en application de règlements européens.
Évolution de la distribution géographique
Description
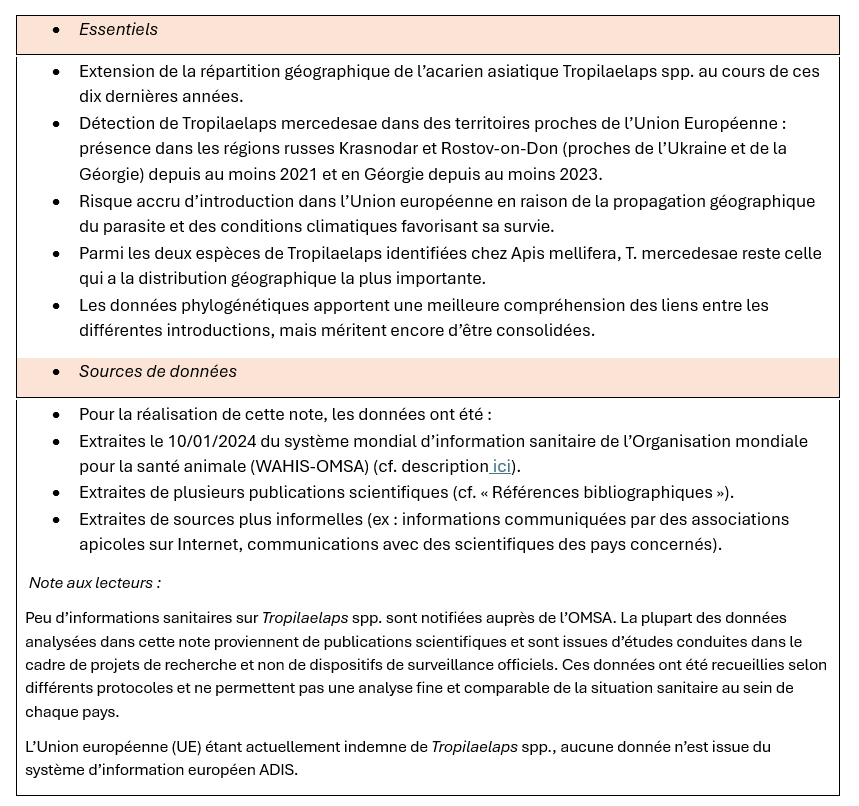
Les acariens du genre Tropilaelaps ont été identifiés pour la première fois à partir des années 1960 dans les zones tropicales ou subtropicales d’Asie où vivent leurs hôtes primaires, les abeilles géantes. Delfinado et Baker ont décrit pour la première fois cet acarien aux Philippines en 1961 (Delfinado et Baker 1961). Depuis, son observation en Asie n’a cessé d’augmenter. La répartition géographique précise de Tropilaelaps et de ses différentes espèces reste cependant relativement mal connue ; peu d’études existent sur le sujet (Figure 1 et 2).
L’espèce T. mercedesae est la plus répandue en Asie. Elle est présente dans des zones au climat tropical mais aussi au climat tempéré (Figure 2).
Tropilaelaps mercedesae a été longtemps confondue avec T. clareae, l’autre espèce parasitant A. mellifera, qui n’a été signalée qu’aux Philippines (à l'exception des îles Palawan) et en Indonésie (de Guzman et al. 2017). L’aire de répartition géographique de T. Clareae est donc beaucoup moins importante que celle de T. mercedesae (Figure 2).
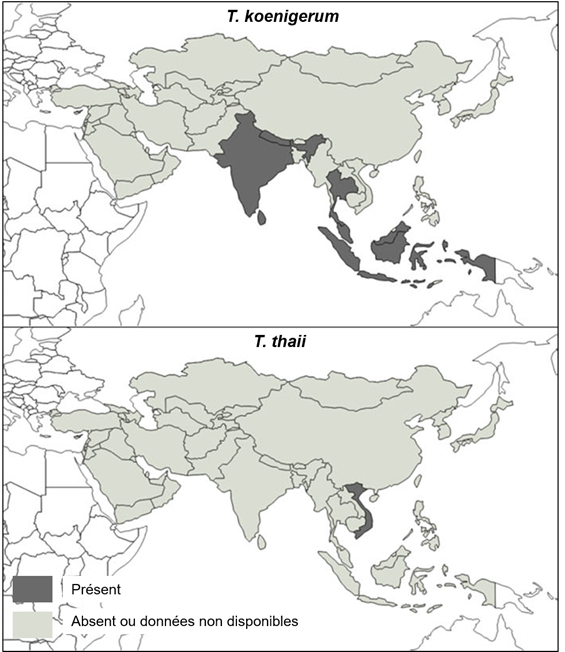
Figure 1 Répartition géographique en 2016 des deux espèces de Tropilaelaps non décrites chez A. mellifera (T. koenigerum et T. thaii) (Chantawannakul et al. 2016)
- Détection dans plusieurs régions en Russie
Fin 2022, une association d’apiculture russe a fait état de pertes importantes de colonies d’abeilles en lien avec la présence de Tropilaelaps dans plusieurs régions de Russie et dans des pays voisins (Ouzbékistan et Tadjikistan en particulier). Ces informations ont été diffusées sur Internet[2].
Depuis, plusieurs publications scientifiques ont confirmé sa présence :
- dans les régions russes de Krasnodar et Rostov, situées au bord de la Mer Noire, entre la Géorgie et l’Ukraine (Brandorf et al. 2024) (Figures 2 et 3). D’après Brandorf et al. (2024), l’acarien serait présent dans ces territoires depuis l’été 2021. L’infestation s’est manifestée par la présence de couvain irrégulier, entraînant un affaiblissement des colonies et des mortalités importantes (53 % de mortalité dans les colonies suivies dans l’étude). Les analyses génétiques ont permis d’identifier l’espèce T. mercedesae.
- dans la région de Tyumen, située dans l’ouest de la Sibérie (Joharchi et Stolbova 2024) (Figures 2 et 3). L’article de Joharchi et Stolbova (2024) ne précise pas à quel moment les Tropilaelaps ont été collectés dans les ruches, ni ne donne d’information sur l’état de santé des colonies infestées par l’acarien. L’identification de l’espèce T. mercedesae a été faite sur la base de critères morphologiques.
- Présence en Ouzbékistan
La présence de T. mercedesae en Ouzbékistan a été confirmée sur la base d’analyses moléculaires et morphologiques pour la première fois en 2024 par Mohamadzade Namin et al. (2024) (Figures 2 et 3). Dans cette étude, les acariens ont été collectés en 2022 dans les environs de Tachkent. En revanche, l’article n’indique pas si l’acarien est présent dans d’autres régions en Ouzbékistan ni quelles sont les conséquences sanitaires observées dans les ruchers infestés.
- Détection en Géorgie
En 2024, la présence de T. mercedesae a été confirmée dans le nord-ouest de la Géorgie, dans la région de Samegrelo-Zemo Svaneti (appelée aussi Mingrélie-et-Haute-Svanétie), proche des territoires russes infestés (Janashia et al. 2024 ; OMSA consultée le 31/01/2025) (Figures 2 et 3). Les résultats de l’étude de Janashia et al. (2024) suggèrent une présence de T. mercedesae dans cette région depuis au moins un an. L’étude, qui a été conduite dans trois ruchers d’A. mellifera caucasica, a également révélé des taux d’infestation parfois élevés des colonies (jusqu’à 24 % de cellules de couvain operculé infestées par Tropilaelaps).
- Présence suspectée au Tadjikistan et en Iran
Des échanges entre le laboratoire Anses de Sophia Antipolis et des scientifiques tadjikes et iraniens laissent également supposer la présence de Tropilaelaps au Tadjikistan et en Iran (communications personnelles en 2022 et en 2024, respectivement) (Figures 2 et 3). D’après ces échanges, les colonies d’abeilles infestées par l’acarien subiraient des pertes importantes.
L’antériorité de la présence de l’acarien dans ces pays n’est pas connue. Les publications de Sammataro, Gerson et Needham (2000) et Shahrouzi (Consulté le 15/01/2025) font écho de la présence de Tropilaelaps en Iran dans les années 2000. Une étude, conduite en 2011-2012, avait montré néanmoins l’absence de Tropilaelaps dans la région montagneuse du nord-est de l’Iran située à la frontière avec le Turkménistan (Moshaverinia 2013).
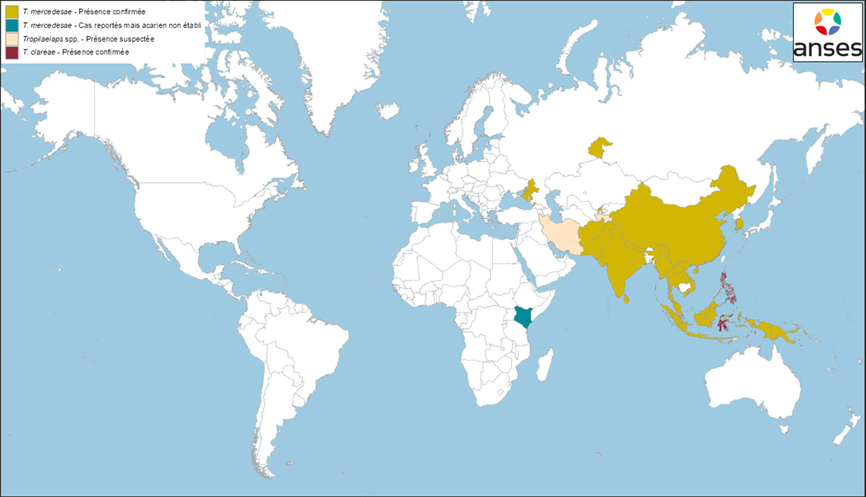
Figure 2 Répartition géographique mondiale des deux espèces de Tropilaelaps décrites chez A. mellifera (T. clareae et T. mercedesae) au 31/12/2024
Sources : données bibliographiques (Anderson et Morgan 2007 ; Chantawannakul et al. 2016 ; de Guzman et al. 2017; Brandorf et al. 2024 ; Mohamadzade Namin et al. 2024 ; Joharchi et Stolbova 2024 ; Janashia et al. 2024 ; Sammataro, Gerson et Needham 2000) et déclarations OMSA (Organisation mondiale de la santé animale (OMSA), base WAHIS consultée le 31/12/2024)
Figure 3 Distribution géographique de T. clareae et T. mercedesae en Asie et en Europe, et nouvelles détections depuis 2016 (au 31/12/2024)
Sources : données bibliographiques (Anderson et Morgan 2007 ; Chantawannakul et al. 2016 ; de Guzman et al. 2017 ; Brandorf et al. 2024 ; Mohamadzade Namin et al. 2024 ; Joharchi et Stolbova 2024 ; Janashia et al. 2024 ; Sammataro, Gerson et Needham 2000) et déclarations OMSA (Organisation mondiale de la santé animale (OMSA), base WAHIS Consultée le 31/12/2024)
Analyse et interprétation
Ces informations ne permettent pas de dépeindre de façon précise la situation épidémiologique dans les territoires concernés car elles ne proviennent pas de dispositifs de surveillance officiels. La plupart des données proviennent de projets scientifiques ciblant l’étude d’un ou de quelques ruchers et n’ayant pas l’objectif de faire un état des lieux de la prévalence de l’acarien et de sa dispersion.
Il est à noter que quasi aucune notification n’a été faite auprès de l’OMSA sur ces différents cas d’introduction, ni d’ailleurs plus largement par l’ensemble des pays infestés par Tropilaelaps. Seule la détection de Tropilaelaps en Géorgie a fait l’objet récemment d’une déclaration dans le système WAHIS (OMSA consultée le 31/12/2024). Par ailleurs, les différentes sources d’information font souvent état d’une détection tardive de l’acarien (généralement au moins un an après la période supposée d’introduction).
Les données de répartition géographique de Tropilaelaps sont donc à considérer avec précaution et invitent à une vigilance accrue dans le cadre des importations d’abeilles en provenance des territoires considérés comme « officiellement indemnes » mais proches géographiquement des zones infestées, ou entraînant des liens commerciaux ou « apicoles » avec ces derniers.
Plusieurs facteurs contribuent à la propagation de Tropilaelaps : - Le pillage et la dérive[3] favorisent la dispersion naturelle de l’acarien entre les colonies d’abeilles, à l’échelle locale ; - Les pratiques apicoles, telles que la division de colonies, le transfert de cadres de couvain entre colonies ou les transhumances ; - Le commerce de colonies, de paquets d’abeilles, nucléi[4], voire de reines ; - Des introductions peuvent enfin se produire via le transport d'essaims infestés installés parfois de façon accidentelle sur des navires (de Guzman et al. 2017). - Les échanges illégaux d’abeilles (ex : commerce de reines notamment), sans contrôles vétérinaires, accroissent le risque de diffusion de l’acarien.
Concernant les cas identifiés ces dernières années, les voies d’invasion ne sont pas connues. Cependant, l’hypothèse d’un lien avec des mouvements d’ordre anthropogénique (transhumances, commerce d’abeilles vivantes notamment) est probable (Janashia, 2024 ; Vidéo extraite de la « Conférence sur l’Apiculture Naturelle - 2022 », Mise en ligne le 5 décembre 2022).
Le changement climatique crée également des conditions propices à la diffusion et à l’établissement de Tropilaelaps (Chantawannakul et al. 2018). En effet, la présence de couvain dans les colonies pendant une grande partie de l’année (phénomène en lien avec le réchauffement du climat), favorise sa multiplication et sa survie pendant l’hiver (de Guzman et al. 2017). La dispersion de T. mercedesae dans des régions aux hivers froids (notamment en Corée du Sud et en Chine) suggère également qu’il pourrait survivre à l’hiver en l’absence de couvain. Les modalités de survie ne sont pas encore connues. Des études restent nécessaires pour mieux comprendre la biologie de l’acarien, notamment chez son nouvel hôte A. mellifera.
Le risque d’introduction dans l’Union européenne via la Turquie[5] est important. La frontière turque est en effet située à moins de 200 km au sud de la région où Tropilaelaps a été détecté en Géorgie. Bien que l’introduction de reines en provenance de Géorgie soit interdite en Turquie, leur commerce illégal pourrait favoriser l’introduction de Tropilaelaps dans ce pays (Janashia et al. 2024 ; communication personnelle). L'apiculture migratoire intensive turque pourrait dans un second temps provoquer sa diffusion rapide vers l’ouest de la Turquie. Le risque d’introduction en Ukraine, via les régions russes de Krasnodar et Rostov, est difficile à évaluer, en raison du contexte géopolitique qui complique la surveillance du parasite. La situation réelle concernant la propagation de Tropilaelaps et sa maîtrise demeureront difficiles à appréhender. |
Aspects génétiques
Description
L’analyse des caractères morphologiques ne permet pas de différencier facilement les différentes espèces de Tropilaelaps. Les premières études génétiques ont été réalisées en 2003 (Tangjingjai et al. 2003), montrant une première divergence entre les deux espèces T. clareae et T. koenigerum. En effet, l'analyse par RDLP[6] des séquences ITS (Internal Transcribed Spacers) a mis en évidence une différence d'environ 4 % sur 600 paires de bases (pb) entre ces deux espèces. De plus, une analyse de l'ADN amplifié par la méthode RAPD[7] a également révélé des différences génétiques. En 2007, le séquençage d’une partie des gènes ITS et de la sous-unité I de la cytochrome C oxydase (COI) des deux espèces T. mercedesae et T. thaii a permis de confirmer les différences observées au niveau des caractères morphologiques (Anderson et Morgan 2007). La différence de nucléotides sur le gène COI a été estimée entre 1 et 4 % au sein d'une même espèce, et entre 11 et 15 % parmi les quatre espèces (Anderson et Morgan 2007). Sur la base de ces résultats, le développement d’une PCR en temps réel suivie d’une courbe de température haute résolution (PCR-HRM) permet aujourd’hui une identification rapide des quatre espèces de Tropilaelaps (Del Cont et al. 2021).
Jusqu’à récemment, le nombre de séquences des deux gènes cités ci-dessus et présentes dans les bases de données n’étaient pas suffisant pour envisager une étude phylogénétique significativement représentative. Mohamadzade Namin et al. (2024) ont pu réaliser une étude phylogénétique sur 112 séquences du gène COI de l’espèce T. mercedesae. Les résultats de cette étude confirment non seulement une divergence génétique au sein de cette espèce mais permettent également d’apporter des informations sur l’origine géographique, les mouvements et la propagation de ce parasite exotique. En effet, selon l’étude, les spécimens présents dans la zone asiatique se distinguent en deux groupes ou « clades » (figure 4) : le clade 1 comprenant un sous-groupe ou « sous-clade » majoritaire (sous-clade continental), et trois sous-clades comprenant des spécimens des zones du Tibet, d’Indonésie et de la Malaisie ; le clade 2 comprenant des spécimens des Philippines et du Sri Lanka.
Concernant les spécimens collectés dans les nouveaux foyers en Russie et en Géorgie, l’analyse in silico des séquences partielles du gène de la COI (Janashia et al. 2024) montre une identité de 96,80 % (avec une couverture de 100 %) entre les deux spécimens de ces foyers. La comparaison des séquences avec celles disponibles dans les bases de données révèle que les spécimens collectés en Russie sont plus proches (identité à 99,83 %) de certains spécimens collectés en Thaïlande, Chine et Inde. Ces deux nouvelles souches feraient donc partie du clade 1, le plus majoritaire (figure 4). Des analyses phylogénétiques complémentaires doivent être entreprises afin de confirmer les liens entre les différentes introductions.
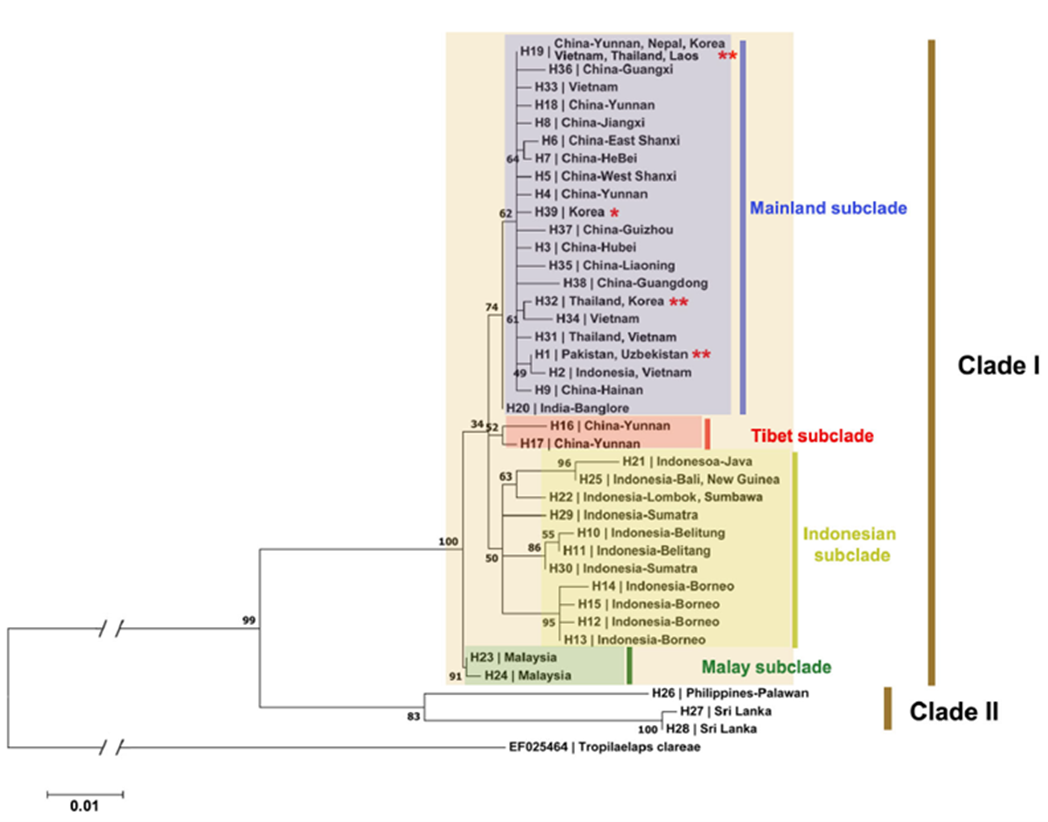
Figure 4. Arbre phylogénétique du maximum de vraisemblance d’une partie du gène COI (538 pb) de 112 séquences de T. mercedesae. (Mohamadzade Namin et al. 2024)
Analyse et interprétation
Les séquences publiées permettent de rattacher génétiquement les spécimens introduits en Russie et en Géorgie au clade le plus majoritaire et présent principalement en Asie. Ces études confortent l’hypothèse de l’influence des échanges entre les régions apicoles des deux pays dans la propagation de souches. Les outils moléculaires deviennent de plus en plus performants pour mettre à jour ces relations. Cependant, les séquences obtenues doivent se situer dans la même région du gène pour une analyse pertinente. Des études moléculaires complémentaires seront nécessaires pour confirmer le lien pressenti. |
Conclusion
Malgré la faible qualité des données épidémiologiques disponibles, plusieurs sources d’informations montrent une extension géographique de l’espèce T. mercedesae ces dernières années vers le centre et l’ouest de l’Asie.
Cette diffusion représente un risque majeur pour la filière apicole au niveau international, et notamment pour l’Union européenne du fait de la présence de Tropilaelaps dans des territoires voisins de l’Ukraine et de la Turquie. Le contexte de réchauffement climatique favorise la propagation et l’installation de l’acarien.
La plupart des introductions n’ont pas été notifiées auprès de l’Organisation mondiale pour la santé animale (OMSA), invitant à une vigilance accrue dans le cadre des mouvements d’abeilles, qui sont des voies de diffusion rapide du parasite. La réglementation sur les importations dans l’UE et les échanges intra-communautaires permet de limiter le risque d’introduction[8].
Les études phylogénétiques apportent des informations sur les relations évolutives entre les différents spécimens de Tropilaelaps présents au niveau international et ainsi, une meilleure compréhension des liens entre les différentes introductions. Elles méritent encore d’être consolidées.
Les conséquences d'une infestation par Tropilaelaps pour les colonies d’abeilles pourraient être plus sévères que celles occasionnées par Varroa destructor[9]. Tropilaelaps se multiplie en effet plus rapidement que Varroa, augmentant ainsi la pression parasitaire sur la colonie. Elles nécessiteraient la mise en place de stratégies de lutte adaptées à la biologie de ce parasite, qui est encore mal connue. Une détection précoce de toute introduction éventuelle est donc essentielle pour tenter d'éradiquer Tropilaelaps et éviter son implantation. Toute suspicion doit être déclarée dans les plus brefs délais au guichet unique de l’observatoire des mortalités et des affaiblissements de l’abeille mellifère (OMAA) de la région concernée au numéro indiqué dans le lien suivant (lien) ou à la direction départementale en charge de la protection des populations du département de localisation du rucher concerné.
| Pour en savoir plus sur Tropilaelaps et comment le reconnaître |
| Brochure du ministère chargé de l’agriculture et de la Plateforme ESA : Les plaquettes Aethina tumida et Tropilaelaps actualisées |
| Réglementation UE (source : DGAL) |
Au niveau européen, Tropilaelaps est classé « D+E ». La catégorie D est une « Maladie à l'égard de laquelle des mesures s'imposent en vue d'en empêcher la propagation en cas d'entrée dans l'Union ou lors de mouvements entre les États membres », et la catégorie E est une « Maladie à l'égard de laquelle une surveillance est nécessaire au sein de l'Union » d’après les Règlement (UE) 2016/429 du 9 mars 2016 et Règlement d'exécution (UE) 2018/1882 de la Commission du 3 décembre 2018. Les règles applicables à l’entrée dans l’UE d’envois de certains animaux, produits germinaux et produits d’origine animale, ainsi qu’aux mouvements et à la manipulation de ces envois sont régies par le Règlement délégué (UE) 2020/692 du 30/01/2020, complétant le règlement (UE) 2016/429. Le Règlement délégué (UE) 2020/688 de la Commission du 17/12/2019 complète le règlement (UE) 2016/429 du Parlement européen et du Conseil en ce qui concerne les conditions de police sanitaire applicables aux mouvements d’animaux terrestres et d’œufs à couver dans l’Union. Le Règlement d’exécution (UE) 2021/404 de la Commission du 24 mars 2021 établit les listes des pays tiers, territoires et zones de pays tiers et territoires en provenance desquels l’entrée dans l’Union d’animaux, de produits germinaux et de produits d’origine animale est autorisée conformément au règlement (UE) 2016/429 du Parlement européen et du Conseil. Le Règlement d’exécution (UE) 2021/403 de la Commission du 24 mars 2021 définit les modalités d’application des règlements (UE) 2016/429 et (UE) 2017/625 du Parlement européen et du Conseil en ce qui concerne les modèles de certificat zoosanitaire et les modèles de certificat zoosanitaire/officiel pour l’entrée dans l’Union et les mouvements entre les États membres d’envois de certaines catégories d’animaux terrestres et de leurs produits germinaux, ainsi qu’en ce qui concerne la certification officielle relative à ces certificats, et abrogeant la décision 2010/470/UE. |
Références bibliographiques
Anderson, D. L. et M. J. Morgan. 2007. "Genetic and morphological variation of bee-parasitic Tropilaelaps mites (Acari: Laelapidae): New and re-defined species." Experimental and Applied Acarology 43 (1): 1-24. https://doi.org/10.1007/s10493-007-9103-0.
Brandorf, Anna, Marija M. Ivoilova, Orlando Yañez, Peter Neumann et Victoria Soroker. 2024. "First report of established mite populations, Tropilaelaps mercedesae, in Europe." Journal of Apicultural Research: 1-3. https://doi.org/10.1080/00218839.2024.2343976.
Chantawannakul, P., L. I. de Guzman, J. Li et G. R. Williams. 2016. "Parasites, pathogens, and pests of honeybees in Asia." Apidologie 47 (3): 301-324. https://doi.org/10.1007/s13592-015-0407-5.
Chantawannakul, P., S. Ramsey, D. vanEngelsdorp, K. Khongphinitbunjong et P. Phokasem. 2018. "Tropilaelaps mite: an emerging threat to European honey bee." Current Opinion in Insect Science 26: 69-75. https://doi.org/https://doi.org/10.1016/j.cois.2018.01.012.
de Guzman, L. I., G. R. Williams, K. Khongphinitbunjong et P. Chantawannakul. 2017. "Ecology, Life History, and Management of Tropilaelaps Mites." Journal of economic entomology 110 (2): 319-332. https://doi.org/10.1093/jee/tow304.
Del Cont, A., B. De Georges, A. Huleux et V. Duquesne. 2021. "Rapid Identification of Tropilaelaps Mite (Mesostigmata: Laelapidae) Species Using a COI Barcode-HRM." Journal of economic entomology 114 (2): 520-529. https://doi.org/10.1093/jee/toaa330.
Delfinado, M.D. et E.W. Baker. 1961. "Tropilaelaps, a new genus of mite from the Philippines (Laelapidae, Acarina)." Fieldiana Zoology 44: 53-56.
Franco, S. et V. Duquesne. 2024. "Tropilaelaps, une menace de plus en plus sérieuse pour l’apiculture européenne." La Santé de l'Abeille (234): 47-59.
Gürler, Ali Tümay, Rahşan Akpınar, Serbülent Yiğit, Selma Kaya, Tuğçe Tuygun, Coşkun Aydın, Şakir Önder Türlek, Cenk Soner Bölükbaş, Aytaç Akçay, Ömer Faruk Bilgiç, Sema Nur Çelik, Cemal Kurt, Mustafa Çetindağ, Ahmet Şimşek, Hakan Yeşilöz, Aysel İtik Ekinci, Sezayi Kaplan, Çağla Korkmaz, Selim Tuncer, Suat Kaymak, Ahmet Deniz, Gökhan Güven, Bilal Küçükoğlu, Murat Yaldız et Şemistan Kızıltepe. 2024. "Investigation of honey bee colonies in terms of mesostigmatid mites in Turkey." Journal of Apicultural Research 63 (2): 350-356. https://doi.org/10.1080/00218839.2024.2309765.
Janashia, Irakli, Aleksandar Uzunov, Chao Chen, Cecilia Costa et Giovanni Cilia. 2024. "First report on Tropilaelaps mercedesae presence in Georgia: The mite is heading westward!" Journal of Apicultural Science. https://doi.org/10.2478/jas-2024-0010.
Joharchi, O. et V. V. Stolbova. 2024. "The first report on the ectoparasitic genus Tropilaelaps (Acari: Mesostigmata: Laelapidae) in Russia." Persian Journal of Acarology 13 (3): 513-516. https://doi.org/10.22073/pja.v13i3.85545.
Mohamadzade Namin, Saeed, Omid Joharchi, Sunil Aryal, Ratna Thapa, Sun-Ho Kwon, Boymakhmat A. Kakhramanov et Chuleui Jung. 2024. "Exploring genetic variation and phylogenetic patterns of Tropilaelaps mercedesae (Mesostigmata: Laelapidae) populations in Asia." Frontiers in Ecology and Evolution 12. https://doi.org/10.3389/fevo.2024.1275995.
Moshaverinia, A. 2013. "Mite infestation of honeybee (Apis mellifera) in apiaries of North East of Iran." Scientia Parasitologica 14: 31-35.
Organisation mondiale de la santé animale (OMSA). Consultée le 31/12/2024. Système mondial d'information sanitaire (WAHIS) :https://wahis.woah.org/#/home.
Sammataro, D., U. Gerson et G. Needham. 2000. "Parasitic mites of honey bees: life history, implications, and impact." Annu Rev Entomol 45: 519-48. https://doi.org/10.1146/annurev.ento.45.1.519.
Shahrouzi, R. . Consulté le 15/01/2025. Natural and chemical control of Varroa destructor and Tropilaelaps mercedesae in Afghanistan. : https://www.apiservices.biz/documents/articles-en/natural_chemical_control_%20of_varroa.pdf
Tangjingjai, W., P. Verakalasa, S. Sittipraneed, S. Klinbunga et C. Lekprayoon. 2003. "Genetic differences between Tropilaelaps clareae and Tropilaelaps koenigerum in Thailand based on ITS and RAPD analyses." Apidologie 34 (6): 513-523.
Ce document créé dans le cadre de la Plateforme d’épidémiosurveillance en santé animale (ESA) peut être utilisé et diffusé par tout média à condition de citer la source comme suit et de ne pas apporter de modification au contenu « © https://www.plateforme-esa.fr/ »
[2] Vidéo extraite de la « Conférence sur l’Apiculture Naturelle - 2022 ». Mise en ligne le 5 décembre 2022. https://www.youtube.com/watch?app=desktop&v=frn1Ffywb4o&feature=youtu.be. Page web consultée le 15/01/2025.
[3]Phénomène par lequel des abeilles butineuses ou des ouvrières retournent accidentellement dans une ruche différente de la leur.
[4] Un nucleus (ou nucléi au pluriel) est une petite colonie d'abeilles utilisée principalement pour l'élevage de reines et la multiplication des colonies. Il est constitué de quelques cadres contenant du couvain, du miel et du pollen, ainsi que d'une petite population d'abeilles ouvrières.
[5] Les dernières données d’enquête publiées datent de 2018/2019 et montrent l’absence de Tropilaelaps dans les 40 provinces turques faisant partie de l’étude (Gürler et al. 2024).
[6] Le RFLP (Restriction Fragment Length Polymorphism) est une technique de biologie moléculaire qui permet de détecter des variations dans les séquences d'ADN en utilisant des enzymes de restriction. Ces enzymes découpent l'ADN à des sites spécifiques, et les fragments obtenus sont séparés par électrophorèse. Les différences de longueur des fragments reflètent des variations génétiques entre individus.
[7] Le RAPD (Random Amplified Polymorphic DNA) est une technique de biologie moléculaire qui utilise des amorces courtes et aléatoires pour amplifier des segments d'ADN par PCR. Les profils de bandes obtenus après électrophorèse révèlent des variations génétiques entre individus ou espèces, sans nécessiter de connaissance préalable de la séquence d'ADN.
[8] Voir site du Ministère de l’agriculture : Importations d’abeilles depuis l’étranger : quelles règles ? | Ministère de l'Agriculture et de la Souveraineté alimentaire (page web consultée le 15/01/2025).
[9] Varroa destructor est un autre acarien parasite de l'Abeille, qui se multiplie dans le couvain. Également originaire d'Asie, il a été introduit en Europe les années 80 et est globalement enzootique actuellement (seuls quelques territoires en sont indemnes).
