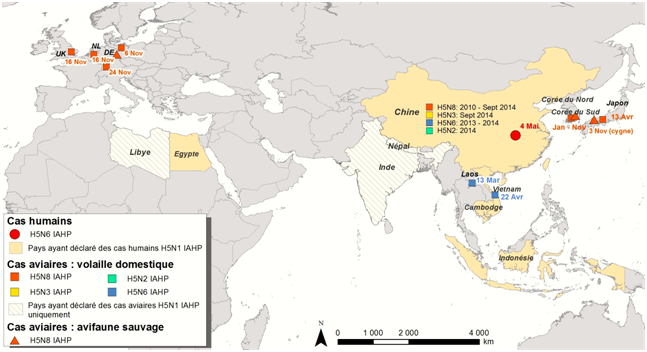
Influenza aviaire en Asie et en Europe : situation au 30 novembre 2014
Marisa Peyre (1,2) (marisa.peyre@cirad.fr), Nicolas Gaidet (1), Alexandre Caron (1,3), Julien Cappelle (1,2,4) Annelise Tran (1,5), François Roger (1)
(1) Cirad, Unité de recherche AGIRs, Montpellier, France
(2) Plateforme régionale GREASE, Bangkok, Thaïlande
(3) Plateforme RP-PCP, Harare, Zimbabwe
(4) Institut Pasteur, Phnom-Penh, Cambodge
(5) Cirad, UMR TETIS, Maison de la télédétection, Montpellier, France
Des foyers d’influenza aviaire hautement pathogène (IAHP) de type H5N8 ont été notifiés en novembre 2014 dans des élevages avicoles d’Europe du Nord. Cette souche est similaire à celle présente en Asie depuis 2010, sans cas humains déclarés. Elle s’apparente au virus IAHP H5N1 circulant toujours sous un mode endémique en Asie depuis 2003 et qui a infecté plus de 650 personnes avec un nombre probable de personnes exposées de plusieurs millions. Les risques de transmission du virus IAHP H5N8 sur de longues distances par les oiseaux sauvages ne peuvent être négligés, mais doivent être examinés de façon comparative aux autres voies d'introduction comme le commerce international de volailles. La gestion des risques liés aux virus H5 doit s’appuyer sur des études relatives aux mobilités animales et humaines et à des méthodes d’évaluation innovantes des systèmes de surveillance et de contrôle.
Des foyers d’influenza aviaire hautement pathogène (IAHP) de type H5N8 viennent de se déclarer dans des élevages avicoles de Grande-Bretagne, Allemagne et Pays-Bas. Cette souche s’apparente aux souches de H5N8 détectées et notifiées en Chine (depuis 2010), au Japon et en Corée (en 2014). Aucun cas de transmission à l’Homme n’a été documenté. Elle ne s'apparente pas à la souche IAHP H5N8 détectée en Europe (Irlande) en 1983.
Quant aux souches IAHP H5N1, IAFP (faiblement pathogène) H7N9 puis maintenant IAHP H5N6, elles circulent toujours en Asie et peuvent représenter une menace pour les élevages avicoles des pays de l’Europe du Nord.
Cet article présente les informations les plus récentes sur la circulation des virus influenza aviaire en Asie et discute des hypothèses d’introduction des virus IAHP en Europe. Il présente également les grands axes des recherches menées par le Cirad ainsi que les besoins en recherche afin d’améliorer la surveillance et le contrôle de ces agents pathogènes.
H5N1 IAHP : endémique en Asie et en Egypte
Le virus influenza IAHP H5N1 (lignée eurasienne) circule en Asie depuis 2003.
En 2014 on a recensé 23 cas humains d’IAHP H5N1 officiellement déclarés dans le monde (Tableau 1). Il est important de noter que dans les pays où le virus est endémique (Cambodge, Chine, Vietnam, Indonésie, Bangladesh, Egypte) tous les foyers aviaires ne sont pas systématiquement rapportés. Dans ces pays, des souches virales de type IAHP H5N1 sont régulièrement isolées lors d’activités de surveillance dans les marchés d’oiseaux vivants et/ou dans le cadre de projets de recherche (Horm et al., 2013).
Tableau 1. Pays ayant déclaré des cas humains d’IAHP H5N1 en 2014
(au 27 novembre 2014)
|
Pays |
Foyers aviaires (volailles) Nombre cumulé (date première déclaration- dernière déclaration) |
Cas humains déclarés à l’OMS nombres cumulés (morts) |
Foyers aviaires ou détection virale déclarés en 2014 |
Cas humains déclarés en 2014 (morts) |
|
Vietnam |
2 723 |
127 (64) |
45 |
2 (2) |
|
Chine |
126 (2003-2014) |
47 (30) |
57 |
2 (0) |
|
Indonésie |
261 (2003-2006)* |
197 (165) |
Pas de déclaration |
2(2) |
|
Egypte |
1 084 (2006-2014)** |
177 (63) |
46 |
8 (2) |
|
Cambodge |
42 (2005-2014) |
56 (37) |
5 |
9 (4) |
Sources :
OIE, WAHIS database: http://www.oie.int/wahis_2/public/wahid.php/Diseaseinformation/statusdetail
* Plus de déclaration de nouveaux foyers depuis le 26 septembre 2006, date à laquelle la situation endémique a été déclarée à l’OIE
** Situation endémique déclarée à l’OIE le 07 juillet 2008 mais poursuite de la déclaration de foyers
Le virus de type H5N1 se décline en dix sous-types qui correspondent à des variants du gène de l’hémagglutinine (HA). Le sous-type 2 représente le groupe le plus détecté depuis 2003 et est divisé en sous-sous-types. Le sous-sous-type 2.2 circule en Egypte, les sous-types suivants ont circulés ou circulent en Asie (année de dernière détection) :.0 (2008), 1 (2013) ; 2 (2.2 (2011) et 2.3 (2014)) et 7 (2013). Récemment le sous-sous-type 2.3.4.6 a été isolé et caractérisé en Chine en 2011 et plus récemment au Vietnam (2014). Les nouvelles souches émergentes de types H5N8 et H5N6 en Asie et plus récemment en Europe s’apparentent toutes au virus H5N1 du sous-sous-type 2.3.4.6, y compris le cas humain de H5N6 déclaré en Chine en 2014.
Emergence de nouvelles souches H5Nx en Asie et en Europe
Des foyers d’IAHP H5N8 ont été rapportés en Chine depuis 2010, en Corée du Sud et au Japon depuis début 2014 et plus récemment (Novembre 2014) en Europe (Allemagne, Pays-Bas et Royaume-Uni) (Figure 1)
En Asie :
La Corée du Sud (Lee et al., 2014) a déclaré son premier cas d’IAHP H5N8 le 19 janvier 2014 dans deux élevages de canards. Depuis, 30 foyers ont été déclarés avec plus de douze millions de volailles abattues (le dernier cas date du 9 novembre 2014). Le virus a été isolé chez des oiseaux sauvages (et plus récemment chez des chiens). Les cas d’infection sur les oiseaux sauvages (n=38) ont dans un premier temps été détectés sur des cadavres d’anatidés migrateurs - Anas formosa (sarcelle élégante), Anas platyrhynchos (canard colvert), Anser fabalis (oie des moissons), Anser albifrons (oie rieuse), Cygnus columbianus (cygne siffleur) - trouvés en relativement grand nombre (n>100) sur un important site d’hivernage de ces oiseaux migrateurs dans le sud de la Corée. Le virus IAHP H5N8 a par la suite été retrouvé chez des canards migrateurs capturés vivants - Anas poecilorhyncha (canard à bec tacheté), Anas platyrhynchos (canard colvert), Anas crecca (sarcelle d’hiver) - dans le cadre d’un programme de surveillance active (Jeong et al., 2014).
Ce virus est apparenté à un virus de type H5N8 détecté en Chine en 2010.
Le Japon a déclaré un premier foyer le 13 avril 2014 dans une ferme, et plus récemment le virus a été détecté chez un cygne siffleur et un canard domestique (novembre 2014). Ces virus sont apparentés au virus H5N8 détecté en Corée du Sud en 2014.
En Chine, le virus H5N8 a été dernièrement isolé (septembre 2014) dans des prélèvements effectués dans des abattoirs (canards et prélèvements environnementaux) dans le cadre de son plan de surveillance nationale.
En Europe :
Le virus a été détecté pour la première fois dans un élevage de dindes (31 000 têtes) en Allemagne le 4 novembre 2014 (notifié le 6 novembre 2014 à l’OIE) et plus récemment (22 novembre 2014) chez un canard migrateur Anas crecca (sarcelle d’hiver).
Il a ensuite été détecté aux Pays-Bas le 14 novembre 2014 dans un élevage de 150 000 poules (notifié à l’OIE le 16 novembre 2014), puis dans trois autres élevages de poules et un élevage de canards (notifications OIE du 19 au 30 novembre 2014) d’une compagnie leader dans la production de volailles et l’exportation d’œufs.
Puis au Royaume-Uni le 14 novembre, dans un élevage de canards (d’une compagnie ayant des activités commerciales en Chine et en Allemagne), cas notifié à l’OIE le 17 novembre 2014.
En Chine, des virus IAHP de type H5N2 (10 foyers, 8 provinces), H5N3 (1 canard positif dans le cadre du plan de surveillance sur les marchés d’oiseaux vivants) et H5N6 (25 foyers, 12 provinces, dernier cas déclaré en août 2014) ont également été isolés en 2014.
Des virus de type H5N6 ont été détectés au Laos (dans le cadre du programme de surveillance) et au Vietnam (7 cas) en 2014 ; ces virus sont apparentés aux virus H5N6 détectés en Chine en 2013 et 2014
Figure 1: Localisation des foyers et des cas incidents d’influenza aviaire hautement pathogène à virus H5Nx, chez l’Homme et l’animal, entre janvier et novembre 2014 (situation au 16 novembre 2014)
Implication en santé publique
Parmi les 200 types différents de virus d’influenza aviaire identifiés à ce jour (toutes espèces animales confondues), seulement un nombre limité peuvent infecter l’Homme : H5, H7, H10, H9, H6 (Song et al., 2014).
Depuis 2003, l’influenza aviaire de type H5N1 a infecté plus de 650 personnes dans le monde avec un taux de létalité (case-fatality rate) de plus de 50 %. En 2014, on a recensé dix-huit cas humains (6 fatals) d’IAHP H5N1 ; un cas humain (fatal) d’IAHP H5N6 (Figure 1). On peut cependant s'attendre à ce qu'un certain nombre de cas mortels ou sévères passent inaperçus ou soient attribués à une autre cause infectieuse. En revanche, le taux de létalité élevé ne retranscrit que le nombre de morts rapporté au nombre total de personnes malades. Récemment, il a été suggéré après des études de sérologie chez l'Homme, que le nombre de personnes exposées sans déclaration officielle de la maladie pourrait s'élever à plusieurs millions, rendant les taux de morbidité et de mortalité de l'IAHP H5N1 beaucoup plus faibles (Morens & Taubenberger, 2014).
Des cas humains dus à d’autres souches sont rapportés et notamment le H7N9 (faiblement pathogène chez les oiseaux) avec plus de 500 cas rapportés depuis mars 2013. La plupart des cas humains sont reliés à une exposition à des volailles vivantes au niveau des marchés (Live-Bird Markets) (Gilbert et al., 2014). Selon un rapport récent du ministère de l’agriculture en Chine[1], 1,4 millions d’échantillons de volaille ont été testés entre mars 2014 et avril 2014 pour la souche IAFP H7N9, et 400 sérums positifs et 116 écouvillons positifs (confirmés par real time RT-PCR) au virus H7N9 ont été rapportés. Le rapport mentionne que dans les zones où aucun échantillon ne s’est révélé positif, aucun cas humain n’a été détecté (à l’exception de Pékin ou 2 cas humains ont été rapportés sans aucun échantillon aviaire positif).
Deux cas humains d’infection au virus IAHP H10N8 ont également été rapportés en Chine (novembre 2013 et févier 2014). Le H10N8 a été détecté chez des canards et des chiens en 2012 (Su et al., 2014) ; une séroprévalence de 2,5 % a été estimée parmi 827 techniciens animaliers échantillonnés, signe d’une infection asymptomatique chez des personnes étroitement en contact avec des volailles (Qi et al., 2013).
Un cas humain d’infection au virus IAHP H5N6 a été rapporté en Chine en avril 2014.
Aucun cas humain d’infection due au virus de type IAHP H5N8 circulant depuis 2013 en Asie n’a été rapporté à ce jour.
La transmission de l’Homme au Porc de la souche humaine H1N1 pandémique (H1N1 pdm09) a été démontrée dans plusieurs pays, notamment au Vietnam (Trevennec et al., 2012) et au Cambodge (Rith et al., 2013). Cette souche peut se recombiner chez le Porc avec d’autres souches. Une nouvelle souche a été ainsi mise en évidence récemment chez le Porc au Vietnam : elle est le fruit d’un réassortiment d’une souche H3N2 et de la souche pandémique H1N1pdm09 (Baudon et al., 2014). Des travaux sont en cours pour déterminer le niveau de protection actuel de la population humaine face à ces nouvelles souches potentiellement zoonotiques (protection croisée possible vis-à-vis de ces nouvelles souches induite par les souches influenza humaine H3N2 et H1N1 circulantes).
Voies d’introduction des virus H5 et H7 en Europe : rôle des oiseaux sauvages et des échanges commerciaux
Des oiseaux sauvages porteurs asymptomatiques
Les oiseaux sauvages peuvent jouer des rôles variés dans l'écologie des virus influenza (Swayne, 2009) à travers la maintenance des souches, leur circulation entre écosystèmes, régions et continents (notamment à travers les comportements de migration saisonnière) ou leur diffusion locale par contact direct entre les oiseaux aquatiques migrateurs et les volailles (Cappelle et al., 2014) et/ou par l'intervention d'espèces relais (Caron et al., 2014).
Les oiseaux migrateurs sont de nouveau mis en cause dans la transmission de la souche H5N8 en Europe du Nord. Cette souche H5N8 a été isolée chez des oiseaux migrateurs en Corée du Sud, au Japon, et en Allemagne, chez des oiseaux asymptomatiques mais également, en Asie, chez des individus trouvés morts. Ces oiseaux auraient pu ainsi depuis ce mois de novembre infecter plusieurs élevages européens ou à l’inverse avoir été infectés par un virus circulant dans les élevages. Cependant, une étude a montré que même si les canards migrateurs ont la capacité de transporter ces virus sur de longues distances en quelques jours, la probabilité d’un tel évènement reste très faible (Gaidet et al., 2010) et une étude récente (Verhagen et al., 2014) suggère que les oiseaux migrateurs agiraient comme amplificateurs locaux de virus influenza plutôt que comme vecteurs sur de longues distances.
D’autre part, les mouvements migratoires se font essentiellement le long d’un axe Nord-Sud. Il n’existe pas de route de migration directe entre les régions asiatiques où le virus a été détecté (Chine, Corée, Japon) et l’Europe de l’Ouest. Une introduction par les oiseaux migrateurs depuis l’Est asiatique nécessite une transmission en Sibérie au cours de l’été entre oiseaux asiatiques et européens qui cohabitent sur certains sites de reproduction partagés. Ce scénario implique donc une série d’évènements (dispersion du virus par oiseaux asiatiques migrateurs - porteurs asymptomatiques vers la Sibérie, persistance du virus en Sibérie pendant le période de reproduction, transmission locale à des oiseaux européens, dispersion du virus par oiseaux européens migrateurs - porteurs asymptomatiques vers l’Europe) dont il est difficile de d’estimer la probabilité d’occurrence (Gale et al., 2014). On notera toutefois que ce type de transmission intercontinentale a pu se produire dans le cas du virus IAHP H5N1. Dans le cas de l’IAHP H5N8, il faut souligner l’absence de foyers détectés en Asie centrale ou en Europe de l’Est comme cela avait été observé lors de la dispersion de l’IAHP H5N1 en 2005, puis en 2006.
A l’heure actuelle, au vu du peu d’informations disponibles sur l’infectiosité, la pathogénicité, le niveau de circulation et les espèces infectées par cette souche IAHP H5N8, il est difficile de déterminer la contribution des oiseaux migrateurs à l’introduction de ce virus en Europe (Anses, 2014).
Ces risques de transmission par les oiseaux sauvages ne peuvent être négligés mais doivent être examinés relativement aux autres risques d'introduction parfois trop mal estimés par manque d'information, tel que le commerce international de volaille et/ou la mobilité humaine liée à la filière aviaire (responsables vétérinaires, agents techniques).
Des mobilités animales et humaines importantes
Plusieurs pistes d’introduction possible du virus IAHP H5N1 en Egypte et au Nigéria ont été identifiées et notamment l’importation de poussins d’un jour depuis la Chine (Ducatez et al., 2006). Des travaux effectués en Asie du Sud-est ont démontré le rôle majeur des intermédiaires dans la filière de distribution des volailles avec notamment un risque d’infection plus élevé lié à la présence ou non de « collecteurs » de volaille (Desvaux et al., 2011). Des travaux récents ont également mis en évidence les risques d’introduction des virus d’IAHP de la Chine vers le Vietnam via le commerce illégal (Desvaux et al., 2014) qui peut être également constaté entre l’Asie et l’Europe.
Dans le cas récent d’infection dû IAHP H5N8 en Angleterre, l’entreprise concernée a également des activités d’élevage de canards en Chine (The Telegraph, Communication personnelle FLI Allemagne). Dès lors, et ce malgré les différences de pratiques d’élevage avérées entre l’Asie et l’Europe, les risques d’introduction des virus IAHP liés au mouvement commercial des oiseaux, d’œufs ou par transfert mécanique à partir de matériel contaminé (cages, vêtements, etc.) ne sont pas à exclure. Les mobilités animales et humaines (poussins de 1 jour, œufs, techniciens animaliers ou vétérinaires qui participent régulièrement à des formations en Asie ou en Europe) doivent être prises en compte dans l’analyse des facteurs de risque d’introduction des virus IA en Europe. Une étude approfondie des échanges commerciaux et de la mobilité des personnes entre l’Europe et l’Asie en lien avec la filière avicole commerciale s’avère nécessaire pour conclure sur les routes d’introduction des virus IAHP en Europe afin de mettre en place des mesures de surveillance et de contrôle adaptées.
Les socio-écosystèmes favorables à la circulation et à la persistance virale sont en particulier ceux associant riziculture et élevage de canards en zones humides, aussi bien en Asie du Sud-est qu’à Madagascar (Paul et al., 2014) et en Egypte. Ces écosystèmes ne sont pas présents en Europe où par contre les élevages et filières industriels, combinés à une perte de diversité génétique peuvent être propices aux émergences et la diffusion des virus influenza (Caron et al., 2009 ; Leibler et al., 2009).
Gestion : surveillance et contrôle
La diffusion et le maintien des virus influenza dans un pays donné dépendent également fortement des performances des services vétérinaires[2] en termes de surveillance et de contrôle.
Des études d’évaluation des protocoles de surveillance en Afrique, en Asie du Sud-est et en Europe sont menées au travers du projet RISKSUR[3] (Development of decision support tools for the design of cost-effective risk-based surveillance systems) et du programme REVASIA (Delabouglise et al., 2014 ; Pham et al., 2013). L’analyse des mouvements d’oiseaux et de porcs au sein des réseaux de filières commerciales a été menée en Egypte (Peyre et al., 2014) et est également en cours en Asie afin de pouvoir mieux cibler les zones et périodes de surveillance.
La surveillance chez les oiseaux sauvages est globalement biaisée et non coordonnée : ponctuelle, géographiquement réduite et souvent limitée aux derniers foyers et à des sous-ensembles de virus (Machalaba et al, In Press). Il y a un besoin d’investissements soutenus pour promouvoir un échantillonnage ad hoc et des tests standardisés, des méthodes de déclaration, incluant le séquençage génétique et le partage des isolats avec la communauté scientifique (EMPRES-i, global animal disease information system)[4] en ciblant les régions où la diversité des virus influenza est importante chez les oiseaux sauvages. Pour comprendre les rôles joués par les oiseaux sauvages, la surveillance des virus aviaires doit davantage s’appuyer sur des études éco-épidémiologiques - ou intégrer le recueil en continu de métadonnées ad hoc - dans lesquelles le rôle des communautés d'oiseaux, de leurs écologies associées, ainsi que leurs interactions avec les populations domestiques sont pris en compte pour cibler la surveillance vers des espèces dont le rôle (maintenance, relai, diffusion à large échelle) est suspecté.
En terme de contrôle, des travaux associant le Cirad et la FAO sont en cours avec l’entreprise Ceva Santé Animale[5] pour l’évaluation sur le terrain de stratégies de vaccination basées sur l’utilisation d’un nouveau vaccin efficace contre la souche H5 chez les poussins d’un jour dans les pays où le H5N1 est endémique. Des vaccins contre les autres souches (H7N9 IAFP, H5N6 IAHP, H5N8 IAHP) sont en cours de développement (communication personnelle, Ceva).
***
Les virus influenza aviaires H5 et H7 circulent toujours largement en Chine et en Asie du Sud-est avec, pour certains, une transmission zoonotique. L’émergence et la diffusion de nouvelles souches sont régulièrement rapportées dans ces régions ainsi qu’en Europe où récemment les services officiels ont déclaré des foyers dus au virus hautement pathogène H5N8. L’atténuation des risques liés à ces virus requiert un renforcement des systèmes de surveillance à la fois pour les volailles domestiques et les oiseaux sauvages. Des travaux plus fondamentaux sont également nécessaires pour comprendre les mécanismes et probabilités de transmission sur de longues distances et ainsi mieux définir et cibler les stratégies de surveillance et de contrôle.
Références bibliographiques
Anses., 2014. Avis de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail relatif à une évaluation du niveau de risque d’introduction en France du virus IAHP H5N8 via l’avifaune et du risque potentiel pour la santé publique lié à cette circulation d’IA HP. Online Access (11/12/2014): https://www.anses.fr/sites/default/files/documents/SANT2014sa0239.pdf .
Baudon, E., Fournie, G., Hiep, D., Ton, V., Peiris, J., Cowling, B., Peyre, M., 2013. Description of the swine production network in a province of northern Vietnam and implications for swine influenza transmission and surveillance, in: Proceedings. Presented at the Hong Kong College of Community Medicine Annual Scientific Meeting, HKCCM. Hong Kong.
Baudon, E., Poon, L.L., Dao, T.D., Pham, N.T., Cowling, B.J., Peyre, M., Nguyen, K.V., Peiris, M., 2014. Detection of Novel Reassortant Influenza A (H3N2) and H1N1 2009 Pandemic Viruses in Swine in Hanoi, Vietnam. Zoonoses Public Health. In Press.
Cappelle, J., Zhao, D., Gilbert, M., Nelson, M.I., Newman, S.H., Takekawa, J.Y., Gaidet, N., Prosser, D.J., Liu, Y., Li, P., Shu, Y., Xiao, X., 2014. Risks of Avian Influenza Transmission in Areas of Intensive Free-Ranging Duck Production with Wild Waterfowl. EcoHealth 11, 109–119.
Caron, A., Gaidet, N., De Garine-Wichatitsky, M., Morand, S., Cameron, E.Z., 2009. Evolutionary biology, community ecology and avian influenza research. Infect. Genet Evol. 9, 298–303.
Caron, A., Grosbois, V., Etter, E., Gaidet, N., De Garine-Wichatitsky, M., 2014. Bridge hosts for Avian Influenza viruses at the wildlife/domestic interface: an eco-epidemiological framework implemented in southern Africa. Prev. Vet. Med. In Press.
Delabouglise, A., Antoine-Moussiaux, N., Phan Dang, T., Truong Dinh, B., Dao Cong, D., Nguyen Tien, T., Nguyen Ngoc Thanh, X., Vu Dinh, T., Nguyen Viet, K., Salem, G., Peyre, M., 2014. Evaluating the social costs and benefits of surveillance: the case of HPAI in Vietnam, in: Proceedings. Presented at the 2nd International Conference on Animal Health Surveillance, ICAHS 2, May 2014, The Havana, Cuba.
Desvaux, S., Grosbois, V., Pham, T., Fenwick, S., Tollis, S., Pham, N., Tran, A., Roger, F., 2011. Risk factors of highly pathogenic avian influenza H5N1 occurrence at the village and farm levels in the red river delta region in Vietnam. Transbound. Emerg. Dis. 58, 492–502.
Desvaux, S., Nguyen, C.O., Vu, D.T., Henriquez, C., Ky, V.D., Roger, F., Fenwick, S., Goutard, F., 2014. Risk of Introduction in Northern Vietnam of HPAI Viruses from China: Description, Patterns and Drivers of Illegal Poultry Trade. Transbound. Emerg. Dis. In Press.
Ducatez, M., Olinger, C., Owoade, A., De Landtsheer, S., Ammerlaan, W., Niesters, H., Osterhaus, A., Fouchier, R., Muller, C., 2006. Avian flu: multiple introductions of H5N1 in Nigeria. Nature 442, 37–37.
Gaidet, N., Cappelle, J., Takekawa, J.Y., Prosser, D.J., Iverson, S.A., Douglas, D.C., Perry, W.M., Mundkur, T., Newman, S.H., 2010. Potential spread of highly pathogenic avian influenza H5N1 by wildfowl: dispersal ranges and rates determined from large-scale satellite telemetry: Potential dispersal of H5N1 HPAI virus by wildfowl. J. Appl. Ecology 47, 1147–1157.
Gale, P., Goddard, A., Breed, A.C., Irvine, R.M., Kelly, L., Snary, E.L., 2014. Entry of H5N1 highly pathogenic avian influenza virus into Europe through migratory wild birds: a qualitative release assessment at the species level. J. Appl. Microbiol. 116, 1405–1417.
Gilbert, M., Golding, N., Zhou, H., Wint, G.W., Robinson, T.P., Tatem, A.J., Lai, S., Zhou, S., Jiang, H., Guo, D., others, 2014. Predicting the risk of avian influenza A H7N9 infection in live-poultry markets across Asia. Nat. Commun. 5.
Horm, S.V., Sorn, S., Allal, L., Buchy, P., 2013. Influenza A(H5N1) Virus Surveillance at Live Poultry Markets, Cambodia, 2011. Emerg. Infect. Dis. 19, 305–308.
Jeong, J., Kang, H.-M., Lee, E.-K., Song, B.-M., Kwon, Y.-K., Kim, H.-R., Choi, K.-S., Kim, J.-Y., Lee, H.-J., Moon, O.-K., others, 2014. Highly pathogenic avian influenza virus (H5N8) in domestic poultry and its relationship with migratory birds in South Korea during 2014. Vet. Microbiol. 173, 249–257.
Lee, Y.-J., Kang, H.-M., Lee, E.-K., Song, B.-M., Jeong, J., Kwon, Y.-K., Kim, H.-R., Lee, K.-J., Hong, M.-S., Jang, I., others, 2014. Novel reassortant influenza A (H5N8) viruses, South Korea, 2014. Emerg. Infect. Dis. 20, 1087.
Leibler, J.H., Otte, J., Roland-Holst, D., Pfeiffer, D.U., Magalhaes, R.S., Rushton, J., Graham, J.P., Silbergeld, E.K., 2009. Industrial food animal production and global health risks: exploring the ecosystems and economics of avian influenza. Ecohealth 6, 58–70.
Machalaba, C.C., Elwood, S.E., Forcella, S., Smith, K.M., Hamilton, K., Ben Jebara, K., Swayne, D.E., Webby, Mumford, E., Mazet, J.A.K., Gaidet, N., Daszak, P., Karesh, W.B., 2015. Global Avian Influenza Surveillance in Wild Birds: A Strategy to Capture Viral Diversity. Emerg. Infect. Dis. In Press.
Morens, D.M., Taubenberger, J.K., 2014. How Low Is the Risk of Influenza A(H5N1) Infection? J. Infect. Dis. pii: jiu530.
Paul, M.C., Gilbert, M., Desvaux, S., Rasamoelina Andriamanivo, H., Peyre, M., Khong, N.V., Thanapongtharm, W., Chevalier, V., 2014. Agro-Environmental Determinants of Avian Influenza Circulation: A Multisite Study in Thailand, Vietnam and Madagascar. PLoS ONE 9, e101958.
Peyre, M.-I., Choisy, M., Sobhy, H., Hassan, W., Dauphin, G., Roger, F., Lubroth, J., Jobre, Y., 2015. Modelling Avian Influenza Immunity Distribution Profile Through the Poultry Production Network in Egypt: a Decision Tool for Zoonotic Influenza Management, in: Proceedings. Presented at the 9th Avian Influenza International Symposium, Athens, GA, USA.
Pham Thi Thanh, H., Nguyen, T.T., Nguyen, V.K., Dao, T.H., Vu, D.T., Baudon, E., Peyre, M.-I., 2013. Using Participatory Epidemiology (PE) approach to prioritize swine diseases at commune level of a red river delta province, North Vietnam, in: Proceedings. Presented at the AITVM 14th International Conference, Johannesburg, South Africa.
Qi, W., Su, S., Xiao, C., Zhou, P., Li, H., Ke, C., Gray, G.C., Zhang, G., Liao, M., 2014. Antibodies against H10N8 avian influenza virus among animal workers in Guangdong Province before November 30, 2013, when the first human H10N8 case was recognized. BMC Med. 12, 205.
Rith, S., Netrabukkana, P., Sorn, S., Mumford, E., Mey, C., Holl, D., Goutard, F., Fenwick, S., Robertson, I., Roger, F., others, 2013. Serologic evidence of human influenza virus infections in swine populations, Cambodia. Influenza Other Respir. Viruses. 7, 271–279.
Song, W., Wang, P., Mok, B.W.-Y., Lau, S.-Y., Huang, X., Wu, W.-L., Zheng, M., Wen, X., Yang, S., Chen, Y., Li, L., Yuen, K.-Y., Chen, H., 2014. The K526R substitution in viral protein PB2 enhances the effects of E627K on influenza virus replication. Nat. Commun. 5, 5509.
Su, S., Qi, W., Zhou, P., Xiao, C., Yan, Z., Cui, J., Jia, K., Zhang, G., Gray, G.C., Liao, M., others, 2014. First Evidence of H10N8 Avian Influenza Virus infections among Feral Dogs in Live Poultry Markets in Guangdong Province, China. Clin. Infect. Dis. ciu345.
Swayne, D.E., 2009. Avian influenza. Wiley-Blackwell. ISBN: 978-0-8138-1866-5. 628 pp
Trevennec, K., Leger, L., Lyazrhi, F., Baudon, E., Cheung, C.Y., Roger, F., Peiris, M., Garcia, J.-M., 2012. Transmission of pandemic influenza H1N1 (2009) in Vietnamese swine in 2009–2010. Influenza Other Respir. Viruses. 6, 348–357.
Verhagen, J.H., Van Dijk, J.G.B., Vuong, O., Bestebroer, T., Lexmond, P., Klaassen, M., Fouchier, R.A.M., 2014. Migratory Birds Reinforce Local Circulation of Avian Influenza Viruses. PLoS ONE 9, e112366.
[1] Promed, 2014. PRO/AH/EDR> Avian Influenza, human (120): China (JS, XJ) H7N9, WHO conf. Archive Number: 20141125.2989241 - http://www.nlintelligence.com/2014/04/03/china-ministry-agriculture-publishes-h7n9-test-results/
[2] http://www.oie.int/fr/appui-aux-membres-de-loie/evaluations-pvs/loutil-pvs-de-loie/
[3] http://www.fp7-risksur.eu/