Influenza aviaire hautement pathogène en France en lien avec le virus H5N8 : premiers éléments d'interprétation épidémio-clinique
Anne Bronner (1), Marie-Cécile Moisson (1), Didier Calavas (2), Pascal Hendrikx (3), Mathilde Paul (4), Claire Guinat (4), Pierre Jabert (5), Guillaume Gerbier (6), Mathilde Saussac (7), Benoît Durand (8), Aurélie Courcoul (8)
(1) DGAl - SASPP, (2) Anses-Lyon, (3) Direction des laboratoires – Anses Maison-Alfort, (4) ENVT, (5) DRAAF Occitanie, (6) DRAAF Grand Est, (7) Unité UCAS – Anses Maison-Alfort, (8) Unité EpiMAI – Anses Maison-Alfort
L'objectif de cet article est d'établir une synthèse des caractéristiques épidémiologiques de l'épizootie qui sévit actuellement en France dans les élevages de volailles, à partir des enquêtes épidémiologiques réalisées dans les foyers et de l'analyse des données issues de la surveillance conduite dans les élevages de volailles.
1. Enquêtes d'investigations épidémiologiques réalisées dans les foyers
1.1. Objectifs
L'objectif premier des enquêtes épidémiologiques est d'identifier, à partir d'un foyer, les élevages en lien amont et en lien aval pour lesquels il peut être nécessaire de mettre en place des mesures de surveillance et/ou de contrôle de la maladie. Les informations obtenues peuvent également permettre d'émettre des hypothèses sur les différents facteurs favorisant la contamination et le risque de diffusion de l'infection dans les élevages. Toutefois, il n'est presque jamais possible de conclure à un lien direct de causalité entre ce ou ces facteurs et la survenue d'un foyer à l'échelle individuelle : un facteur jugé peu probable peut avoir en réalité été à l'origine de la contamination et seules des études de type cas-témoins peuvent permettre d'évaluer l'effet de facteurs de risque à une échelle populationnelle. Dans certains cas très rares, l'investigation peut permettre à l'échelle individuelle d’écarter « avec certitude » un facteur ou, à l'inverse, d'en identifier un avec certitude.
1.2. Matériel et méthode
Les investigations épidémiologiques ont été conduites dans les foyers d'IAHP à partir d'un questionnaire d'enquête établi par l'Anses et la DGAl, et mis en œuvre par les agents des services départementaux (a minima un agent de ces services mobilisé pour chaque enquête), avec un appui des services régionaux ou d'épidémiologistes dans certains cas. Une synthèse de ces enquêtes a été demandée par la DGAl, en mentionnant pour chaque foyer :
- les différents facteurs potentiels d'introduction de l'IA : par une transmission directe via l'introduction de volailles domestiques ou de l'avifaune infectées, ou par une transmission indirecte (volailles domestiques en contact avec des éléments souillés) via le personnel et les personnes en contact avec les élevages, les véhicules (camions de transport d'animaux, d'aliments, d'équarissage par ex. et visiteurs), l'échange de matériel, les aliments à destination des volailles, ou la litière
- le niveau de probabilité de ces potentiels facteurs d'introduction : « probabilité inconnue », « peu probable », « très probable », ou « lien avéré ».
1.3. Résultats
Entre le 28 novembre 2016 et le 6 février 2017 (date d'arrêt des données pour les analyses), 203 foyers d'IAHP avaient été recensés en élevage domestique et 62 d'entre eux (31%) avaient fait l’objet d’une enquête épidémiologique matérialisée par un rapport et/ou un bilan synthétique d'enquête sur l'origine probable du foyer. La faible proportion de foyers pour lesquels des informations étaient disponibles sur les hypothèses de contamination peut tenir d'une part au fait que ces enquêtes détaillées sont considérées comme secondaires par les services départementaux par rapport à la mise en œuvre des mesures de gestion et à la recherche des élevages en lien épidémiologique et d'autre part à la difficulté pratique de mettre en œuvre de telles enquêtes dans un contexte de crise (effectifs et temps alloués). Par ailleurs, il convient de souligner que les interprétations des hypothèses d'introduction méritent d'être prises avec précaution, car éventuellement sujettes à une part de subjectivité de l'enquêteur. Au vu des données disponibles, aucune hypothèse sur l’origine de la contamination de l’élevage n'a pu être identifiée pour 13 foyers (21 %, 13/62). Un lien avéré, identifié avec certitude, a pu être mis en évidence dans 8 foyers sur 49, dans le cadre d'introduction de volailles d'élevage infectées. Parmi les 49 foyers pour lesquels une hypothèse sur l'origine a pu être émise, 19 ont une hypothèse d’origine unique, dont plus de la moitié est associée à un lien direct (58 %, 11/19) et un peu moins de la moitié à un lien indirect (42 %, 8/19).
Parmi les 36 foyers pour lesquels au moins une origine a été identifiée à un niveau de probabilité élevé (« très probable » ou « lien avéré »), les véhicules (39 %, 14/36), l'avifaune (36 %, 13/36) et l'introduction de volailles d'élevage infectées (31 %, 11/36) figuraient comme les hypothèses de contamination identifiées le plus souvent par les enquêteurs à un niveau de probabilité élevé.
2. Analyse des données issues de la surveillance et dynamique de propagation de l'infection
2.1. Objectif
L'objectif de cette analyse était de décrire la dynamique de propagation de l'infection, dans le temps et l'espace, et d’émettre des hypothèses sur les modalités de diffusion de l'infection.
2.2. Matériel et méthode
-
Analyse descriptive de l'évolution spatio-temporelle des foyers
Les données utilisées pour l'analyse descriptive des foyers sont les données sanitaires relatives aux foyers d'IAHP au 6 mars 2017 (n=424 foyers, dont 51 dans des élevages de galliformes).
-
Analyse de la dynamique de propagation de l'infection
Les données utilisées pour l'analyse de la dynamique de l'infection sont : i) les données sanitaires relatives aux foyers d'IAHP arrêtées au 24 février ; ii) les données relatives aux ateliers de volailles enregistrés dans Sigal, en excluant les basse-cours (pour lesquelles l'information est jugée non fiable) ; iii) les données relatives aux abattages préventifs réalisés dans certaines communes des départements 32, 40, 64 et 65 au 24 février 2017: soit 625 ateliers pour lesquels une date d’abattage était connue à la date du 24 février, situés dans 189 communes.
L'analyse des distances de propagation, des délais d'abattage et du taux d'attaque a été réalisée à partir d'un jeu de données restreint de foyers, en ciblant ceux déclarés à la DGAl au 24 février 2017, pour la zone Sud-Ouest (départements 31, 32, 40, 64 et 65), pour lesquels on disposait de coordonnées géographiques et pour lesquels la date de suspicion était renseignée (n=315 foyers, dont 32 dans des élevages de galliformes). Les ateliers d’un même établissement ont été regroupés en sites sur la base de la distance entre ateliers (regroupement des ateliers situés à moins de 250 m en un seul site, la position du site étant la position moyenne des ateliers). Certains établissements pouvaient donc être multi-sites (lorsqu’ils possédaient deux groupes d’ateliers distants eux-mêmes de plus de 250 m).
La dynamique de l’épizootie a été analysée au travers de deux paramètres : la distance au plus proche foyer et le taux d’attaque.
La distance entre un foyer déclaré une semaine donnée et le plus proche foyer antérieurement détecté a été calculée pour les foyers pour lesquels aucun lien épidémiologique évident n'avait été identifié (les élevages en lien épidémiologique étant donc traités à part).
La proportion d'élevages infectés autour d'un foyer clinique, ou « taux d'attaque », a été calculée comme le rapport entre (i) le nombre d'élevages découverts infectés dans un rayon de 1 à 10 km autour du foyer clinique, potentiellement liés à ce foyer et déclarés postérieurement (strictement) à la découverte de celui-ci, et jusqu'à sept jours suivant son abattage (estimation d'un délai d'incubation de 7 jours entre l'infection des élevages voisins à partir des animaux du foyer et la découverte de signes cliniques ou de résultats non négatifs dans ces mêmes élevages), et (ii) le nombre total d'élevages dans la zone, en excluant les élevages ayant fait l'objet d'un abattage préventif (population exposée au risque d’infection par le foyer considéré). L'analyse a ciblé les élevages cliniquement atteints car considérés comme présentant les niveaux d'excrétion les plus élevés. Les dates retenues sont les dates de déclaration des suspicions à la DGAl.
A noter que ces calculs sont dépendants de la qualité des données relatives aux élevages de palmipèdes et de galliformes présents dans la zone (la déclaration obligatoire des élevages étant relativement récente), ainsi que de la qualité des données relatives aux opérations de dépeuplement (supposée très bonne, car utilisée par la suite pour indemniser les éleveurs). Par ailleurs, une partie des ateliers des élevages de la zone peuvent être vides en raison d'un arrêt temporaire de la production : ce paramètre n'est pas connu et donc pas pris en compte dans les calculs, ce qui peut conduire à sous-estimer les taux d'attaque.
2.3. Résultats
2.3.1. Evolution spatio-temporelle des foyers
-
Evolution spatio-temporelle des foyers par département
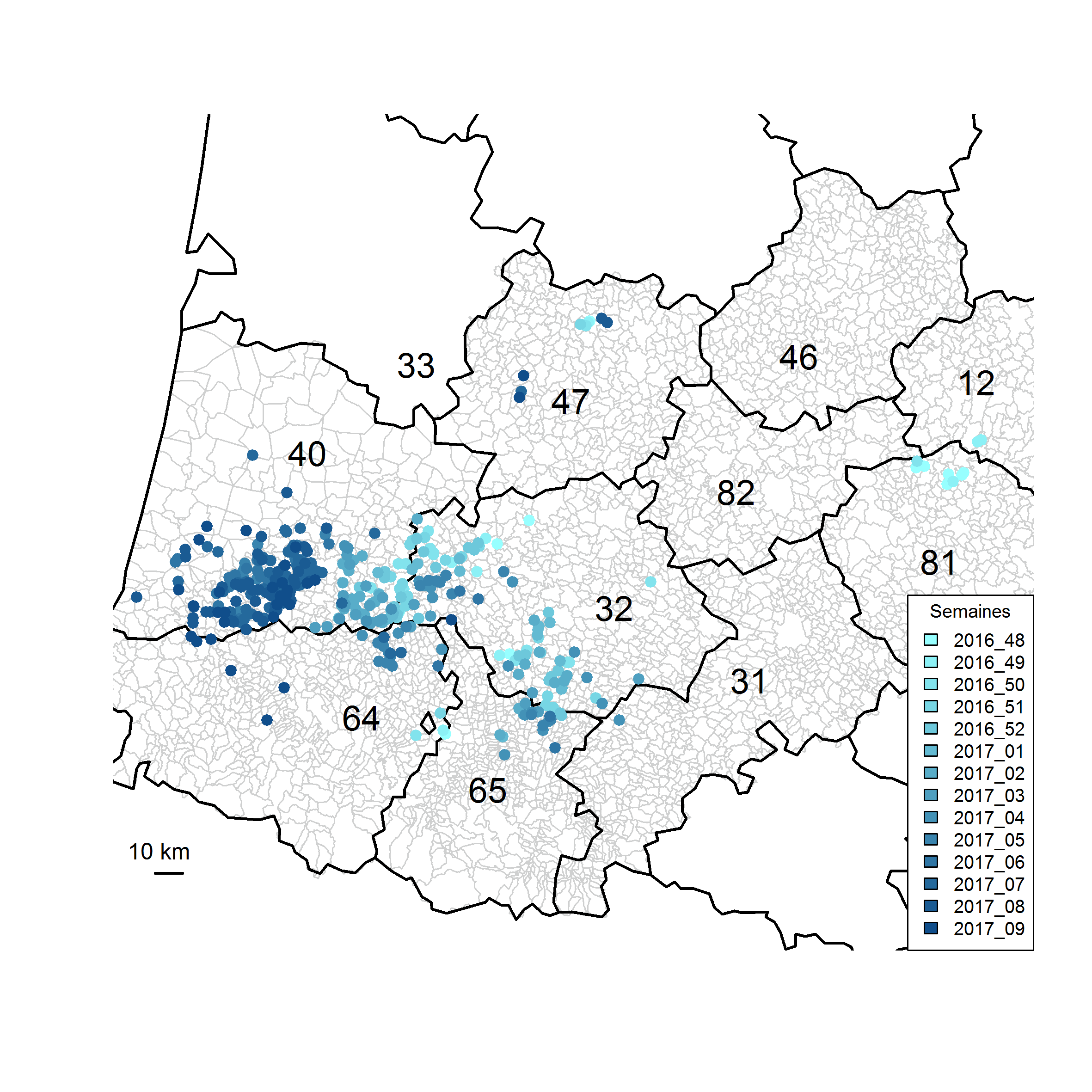
D'après le point de situation en date du 6 mars 2017, disponible sur le site de la Plateforme ESA, les départements du sud-ouest (32, 40, 64, 65), qui concentrent la majorité des élevages de production de palmipèdes gras en France, étaient les départements les plus impactés, et en particulier les départements des Landes et du Gers. Le département des Landes concentrait la très grande majorité des foyers recensés en élevage de palmipèdes (58%, 196/338) et de galliformes (73%, 37/51).
Par ailleurs, tandis que le nombre hebdomadaire de foyers incidents était en diminution dans le département du Gers à compter de la première semaine de janvier (semaine 17-01), jusqu'à devenir nul depuis la deuxième semaine de février (semaine 17-07), le nombre hebdomadaire de foyers incidents dans le département des Landes n'a cessé d'être élevé depuis la deuxième semaine de janvier. Ainsi, dans le sud-ouest de la France, l'évolution de la détection des foyers s'est faite d'est en ouest, touchant dans un premier temps majoritairement le département du Gers, puis celui des Landes (Figure 1).
Figure 1 : Evolution spatio-temporelle hebdomadaire des foyers d'IAHP déclarés dans les élevages de volailles entre le 28 novembre 2016 (déclarartion du premier cas d'IAHP, semaine16-48) et le 6 mars 2017.
Les 412 foyers pour lesquels l'information relative à la catégorie d'élevage était disponible (palmipèdes, galliformes ou élevages mixtes détenant les deux) ont été localisés dans 210 communes : 26% (54/210) des communes concernées par la détection de foyers en élevage de galliformes ou en élevages mixtes (dont 65% (35/54) également concernées par la détection de foyers en élevages de palmipèdes, soit 35% (19/54) des communes concernées par la présence de foyers en élevage de galliformes et pour lesquelles aucun foyer n'était connu en élevage de palmipèdes), et 74% (156/210) des communes concernées par la détection de foyers en élevages de palmipèdes uniquement.
-
Evolution spatio-temporelle des foyers par origine de suspicion
D'après le point de situation en date du 6 mars 2017 disponible sur le site de la Plateforme ESA, les foyers détectés en élevage de palmipèdes l'ont été majoritairement par la surveillance événementielle jusqu'à la deuxième semaine de janvier (semaine 17-02), semaine à partir de laquelle la surveillance par les dépistages réalisés lors des abattages préventifs a permis de détecter davantage de foyers (excepté la dernière semaine de janvier (semaine 17-04) et la troisième semaine de février (semaine 17-07)). Les dépistages réalisés avant mouvements d'animaux permettent également de détecter davantage de foyers que la surveillance événementielle à compter de la première semaine de février (semaine 17-05) (exceptée la troisième semaine de février (semaine 17-07)). Concernant les élevages de galliformes, la surveillance événementielle reste le type de surveillance par lequel la très grande majorité des foyers a été détectée.
2.3.2. Distance au plus proche foyer
La propagation de l’IAHP s’est faite de proche en proche pour la majorité des foyers (dans un rayon de 10 km). Depuis le début de l'épizootie, seuls quelques foyers (6%, 18/290) ont été détectés à une distance de plus de 10 km du foyer antérieur le plus proche (Tableau 1). Sur ces 18 foyers, on comptait 15 élevages de palmipèdes, un élevage de galliformes et deux élevages mixtes.
Le nombre hebdomadaire de foyers et leur répartition dans l'espace ont peu évolué d'une semaine à l'autre courant janvier (semaine 17-01 à 17-04 inclus) : le nombre hebdomadaire de foyers variait entre 17 et 27 foyers (hors foyers en lien épidémiologique), avec des contaminations majoritairement de proche en proche (entre 0 à 2 foyers détectés à plus de 10 km par semaine).
Le nombre de foyers a augmenté à partir de la dernière semaine de janvier (du 30 janvier au 5 février 2017, semaine 17-05), avec une diffusion à des distances plus importantes (7 foyers détectés à plus de 10 km la dernière semaine de janvier). Ces sept foyers ont été détectés dans la zone à forte densité de palmipèdes des Landes, en Chalosse.
L'augmentation du nombre de foyers s'est poursuivie au cours des première et deuxième semaines de février (semaines 17-06 et 17-07) avec 40 et 58 foyers détectés respectivement, mais une contamination principalement de proche en proche (un seul foyer détecté à plus de 10 km des précédents sur ces deux semaines).
Tableau 1 : Distance au foyer antérieur le plus proche pour tous les foyers.
| Semaine | Nombre de foyers selon la distance au plus proche foyer détecté antérieurement (hors liens épidémiologiques) |
Nombre de foyers détectés via les liens épidémiologiques | Nombre total de foyers | Nombre total de foyers (hors liens épidémiologiques) |
Proportion de foyers à plus de 10 km du plus proche foyer (hors liens épidémiologiques) |
|||
| 0-1km | 1-3km | 3-10km | >10km | |||||
| 16-48 | 0 | 0 | 0 | 0 | 0 | 4 (foyers dits index) | 4 (foyers dits index) | 0,00 |
| 16-49 | 1 | 0 | 3 | 1 | 2 | 7 | 5 | 0,20 |
| 16-50 | 3 | 0 | 5 | 2 | 5 | 15 | 10 | 0,20 |
| 16-51 | 2 | 8 | 8 | 1 | 3 | 22 | 19 | 0,05 |
| 16-52 | 4 | 15 | 7 | 0 | 2 | 28 | 26 | 0,00 |
| 17-01 | 5 | 8 | 4 | 2 | 0 | 19 | 19 | 0,11 |
| 17-02 | 4 | 10 | 12 | 1 | 1 | 28 | 27 | 0,04 |
| 17-03 | 2 | 7 | 8 | 0 | 0 | 17 | 17 | 0,00 |
| 17-04 | 3 | 7 | 9 | 2 | 3 | 24 | 21 | 0,10 |
| 17-05 | 1 | 10 | 12 | 7 | 4 | 34 | 30 | 0,23 |
| 17-06 | 9 | 19 | 10 | 1 | 1 | 40 | 39 | 0,03 |
| 17-07 | 18 | 25 | 14 | 1 | 0 | 58 | 58 | 0,02 |
| 17-08 | 6 | 6 | 3 | 0 | 0 | 15 | 15 | 0,00 |
| Total | 58 | 115 | 95 | 18 | 21 | 311 | 290 | 0,07 |
2.3.3. Taux d'attaque autour des foyers cliniques
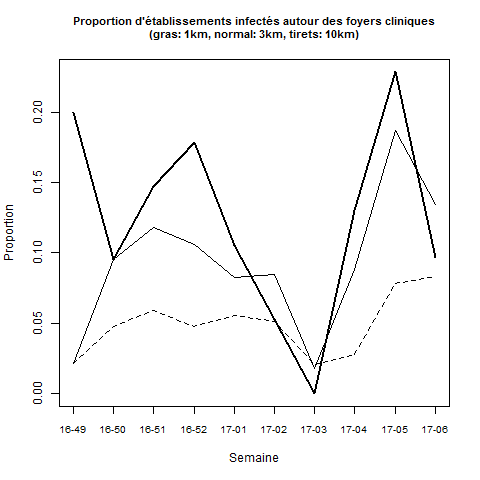
Sur l'ensemble de la période, le taux d'attaque, calculé en intégrant le dépeuplement autour des foyers cliniques, est faible quelle que soit la distance (souvent inférieur à 10% dans un rayon de 3km, et inférieur à 15% dans un rayon de 1km, Figure 2). Ce résultat ne permet pas d’identifier les facteurs explicatifs d'une propagation de proche en proche ni d'exclure une éventuelle transmission aéroportée (i.e. diffusion de particules virales par voie aérienne, avec ou sans support, telles que des poussières, des plumes, etc.). En revanche, il permet de dire que, même si la transmission aéroportée joue un rôle, la probabilité de s’infecter via ce mode de transmission reste faible : dans le cas inverse, on s'attendrait à un gradient d'infection décroissant avec l'éloignement par rapport au foyer clinique alors que dans le cas présent, le taux d'attaque reste globalement inchangé quelle que soit la distance retenue pour le calculer, entre 1 et 10 km..
Le taux d'attaque a varié selon les semaines : il a augmenté courant décembre (entre les semaines 16-49 et 16-51), avant de diminuer fortement jusqu'à la 3ème semaine de janvier puis de remonter fortement aux cours de la dernière semaine de janvier et première semaine de février.
Cette augmentation du taux d'attaque fin janvier et début février explique en partie l'augmentation des foyers détectés dans un rayon de 1 à 10 km autour d'un précédent foyer au cours des trois premières semaines de février (Tableau 1).
Figure 2 : Evolution de la proportion d’établissements infectés autour d’un foyer clinique (taux d'attaque) selon la semaine de déclaration du foyer clinique et la distance à ce foyer. Ne sont pris en compte que les foyers cliniques abattus avant le 17 février. Ne sont comptabilisés que les établissements pour lesquels la date de déclaration de l’infection est postérieure à celle du foyer clinique, et antérieure à la date d’abattage du foyer clinique plus sept jours. Les abattages préventifs sont pris en compte dans le calcul.
2.3.4 Évaluation de l'effet de l'espèce et du délai d'abattage sur le taux d'attaque autour des foyers cliniques
Le taux d'attaque a été modélisé par un modèle de Poisson dans lequel la variable à prédire était le nombre d’élevages infectés détectés autour d’un foyer clinique pendant la période d’intérêt pour cet élevage (i.e. entre la date de déclaration de suspicion dans le foyer clinique et sa date d’abattage plus 7 jours). Afin de prendre en compte les mesures de dépeuplement, la population exposée était prise en compte dans le modèle sous la forme d’un nombre d’élevages-périodes dans un périmètre donné autour du foyer (un élevage non dépeuplé comptant pour 1, et un élevage dépeuplé au milieu de la période d’intérêt comptant pour 0,5). Les variables explicatives étaient l'espèce élevée dans le foyer et le délai d’abattage (nombre de jours entre la date de déclaration de suspicion dans le foyer clinique et la date de son abattage, cette variable ayant été catégorisée en quatre modalités, définies selon l'écart inter-quartile du délai d'abattage).
A ce stade, il apparaît que les taux d'attaque dans les 3 et 10 km autour d'un foyer clinique sont significativement plus faibles lorsque le foyer concerne un élevage de galliformes, et lorsque le foyer a fait l'objet d'un abattage rapide (Tableau 2). L'absence d'effets significatifs des variables explicatives dans un rayon d'1km peut s'expliquer par un manque de puissance (en raison des faibles effectifs).
Ainsi, l'augmentation du taux d'attaque décrite fin janvier / début février pourrait s'expliquer par l’augmentation des délais entre suspicion et abattage des foyers. Il est probable également que la propagation de l’infection dans une zone à forte densité d’élevages ait contribué fortement à une diffusion active de l'infection.
Tableau 2: Relation entre la proportion d’établissements infectés autour d’un foyer clinique (taux d'attaque), l’espèce présente dans ce foyer et le délai en jours entre la date de déclaration à la DGAl et la date d’abattage de ce foyer. Ne sont pris en compte que les foyers cliniques abattus avant le 17 février. Ne sont comptabilisés que les établissements où l’infection a été suspectée à cause de signes cliniques, pour lesquels i) la date de déclaration de l’infection est postérieure à celle du foyer clinique et antérieure à la date d’abattage du foyer clinique plus sept jours et ii) il existe des élevages de volailles dans les 1, 3 ou 10 km (N=88 foyers pour le taux d’attaque à 1km et 109 foyers pour les taux d’attaque à 3 km et 110 foyers pour celui à et 10 km). L’odds-ratio indiqué pour le délai d’abattage correspond à une augmentation du délai de 4 jours (l’écart inter-quartiles de la distribution des délais d’abattage).
| 1 km | Odds-ratio | IC* 2,5% | IC 97,5% | p** |
| Espèce Galliformes (réf) Palmipèdes |
1 0,42 |
0,08 | 1,29 | NS |
| Délai d’abattage | 1,17 | 0,67 | 1,99 | NS |
| 3 km | Odds-ratio | 2,50% | 97,50% | p |
| Espèce Galliformes (réf) Palmipèdes |
1 2,81 |
1,44 | 6,47 | 0,008 |
| Délai d’abattage | 1,32 | 1,05 | 1,65 | 0,017 |
| 10 km | Odds-ratio | 2,50% | 97,50% | p |
| Espèce Galliformes (réf) Palmipèdes |
1 1,67 |
1,18 |
2,45 |
0,007 |
| Délai d’abattage | 1,41 | 1,25 | 1,6 | <0,0001 |
* IC : intervalle de confiance
**p : p-value. NS signifie que la p-value est supérieure à 0,05, avec un effet non significatif.
Interprétation et conclusion
L'épisode actuel touche particulièrement la filière de palmipèdes, avec une diffusion de l'infection entre élevages survenant principalement de proche en proche, les foyers détectés étant situés à moins de 10 km d'un précédent foyer, excepté au cours de la première semaine de février, au cours de laquelle l'infection a atteint le département des Landes en pleine Chalosse. Même si leurs conclusions méritent d'être considérées avec précaution, les enquêtes épidémiologiques pour lesquelles les résultats sont disponibles soulignent un rôle à la fois des mouvements de transports et d'animaux, et de l'avifaune. Les analyses détaillées de la dynamique de propagation de l'infection indiquent que le rôle de la transmission aéroportée est probablement faible par rapport à d'autres modes de transmission.
L'avifaune et la diffusion aéroportée sont évoqués à plusieurs reprises par les acteurs de terrain comme potentiels facteurs de risque d'introduction de la maladie et de diffusion de l'épizootie (transport passif de particules virales, rôle éventuel de la tempête survenue le 3 février (semaine 17-06) dans les Landes), que ce soit à l'occasion d'enquêtes épidémiologiques ponctuelles au cours desquelles aucun facteur de contamination n'apparaît évident, ou de manière plus large. Cependant, au-delà des limites soulignées précédemment en ce qui concerne les enquêtes épidémiologiques, en l'état actuel des connaissances, il est impossible de quantifier la part de ces deux facteurs dans la propagation de l'épizootie. Par ailleurs, même si les galliformes pourraient être moins réceptifs que les palmipèdes à une infection par un virus IAHP (Bertran et al., 2016 ; Pantin-Jackwood et al., 2016), le fait que les élevages de galliformes soient moins touchés que les élevages de palmipèdes semble conforter l'hypothèse selon laquelle les principaux facteurs de diffusion sont liés aux mouvements d'animaux, de véhicules et de personnes, nettement plus intenses au sein de la filière palmipèdes gras qu'au sein de la filière gallus (notamment en raison d'une segmentation des étapes d'élevage plus importante au sein de la filière palmipèdes gras).
Ainsi, comme le soulignent également les avis de l'Anses n° 2017-SA-0026 et n° 2017-SA-0028 , l'avifaune et la diffusion aéroportée semblent jouer un rôle non prépondérant dans l'épisode en cours. En revanche, les mouvements d'animaux, personnes et véhicules internes à la filière de palmipèdes apparaissent jouer un rôle prépondérant dans la diffusion de l'infection. La propagation de l'infection est par ailleurs favorisée par les conditions climatiques, propices à un maintien du virus dans l'environnement, et ce d'autant plus que les charges virales excrétées par les animaux apparaissent élevées.
Le nombre de foyers hebdomadaires a augmenté légèrement courant janvier, avec un taux d'attaque autour des foyers cliniques diminuant par ailleurs. Cette situation pourrait s'expliquer par des délais d'abattage courts, et le dépeuplement des élevages autour des foyers détectés alors dans le département du Gers.
A partir de la dernière semaine de janvier et au cours des trois premières semaines de février, le nombre de foyers a augmenté de manière importante, cette augmentation étant en partie liée à l'augmentation de la pression de surveillance, résultant d'une part du dépistage systématique à l'abattoir des animaux faisant l'objet d'un abattage préventif (25 %, 108/424 des foyers détectés dans ce cadre au 6 mars 2017) et d'autre part du dépistage systématique des animaux avant sortie de zone réglementée (17 %, 74/424 des foyers détectés dans ce cadre au 6 mars 2017). Cette augmentation était également liée à l'augmentation du taux d'attaque autour des foyers cliniques à partir de fin janvier, pouvant être expliquée par l'arrivée de l'infection dans une zone à très forte densité à partir de la 1ère semaine de février (la Chalosse), et une augmentation des délais d'abattage des foyers.
Ces résultats descriptifs sont fondés sur les données disponibles et analysées à une date donnée et leur interprétation est bien évidemment susceptible d’évoluer, notamment avec des données plus précises sur les facteurs pouvant influencer la proportion d'élevages infectés, qui, au delà de la taille des élevages, peuvent porter sur la densité d'élevages, l'effet du dépeuplement, la présence d'élevages vides la mise en place de restrictions de mouvements dans un rayon de 10km, etc.
Des études complémentaires, bibliographiques et d'épidémiologie analytique seront par ailleurs nécessaires afin d'objectiver et quantifier l'effet des différents facteurs dans la diffusion de l'infection, qu'il s'agisse du rôle de la diffusion aéroportée ou de l'avifaune (complexes à étudier) ou de l'effet du dépeuplement sur la maîtrise de l'infection. D'autres études complémentaires sont également envisagées afin de mieux comprendre le lien éventuel entre la contamination des élevages de palmipèdes et celles des élevages de galliformes, à noter que ce lien ne semble pas être direct au vu des premières analyses descriptives à l'échelle de la commune.
Bibliographie
Bertran, K., Swayne, D.E., Pantin-Jackwood, M.J., Kapczynski, D.R., Spackman, E., Suarez, D.L.
Lack of chicken adaptation of newly emergent Eurasian H5N8 and reassortant H5N2 high pathogenicity avian influenza viruses in the U.S. is consistent with restricted poultry outbreaks in the Pacific flyway during 2014-2015 (2016) Virology, 494, p. 190-197.
Pantin-Jackwood, M.J., Costa-Hurtado, M., Shepherd, E., DeJesus, E., Smith, D., Spackman, E., Kapczynski, D.R., Suarez, D.L., Stallknecht, D.E., Swayne, D.E.
Pathogenicity and transmission of H5 and H7 highly pathogenic avian influenza viruses in mallards (2016) Journal of Virology, 90 (21), p. 9967-9982.