Point au 16/09/2020 sur la mimivirose des esturgeons et l’anémie infectieuse des saumons en Europe
Pour le comité de rédaction de la Plateforme ESA (par ordre alphabétique) :
Sophie Carles, Julien Cauchard, Céline Dupuy, Guillaume Gerbier, Yves Lambert, Renaud Lancelot
Pour le LNR Anses : Laurent Bigarré
Pour la DGAL : Isabelle Guerry
Pour l’ADILVA : Nicolas Keck
Auteur correspondant : laurent.bigarre@anses.fr
Situation de la mimivirose des esturgeons en Europe
Les premières détections de l’Acipenser iridovirus-Européen (AcIV-E) dans deux pays de l’Est, Roumanie et Ukraine ont été notifiées le 04/09/2020 (source : LNR Anses).
Ce virus, en voie de re-classification dans la famille des Mimiviridae, provoque une maladie à impact variable chez les esturgeons d’élevage (mortalité parfois supérieure 80 % chez les juvéniles, voir figure 1). Découverte initialement sur le continent Américain, puis décrite pour la première fois en Europe de l’Ouest en 1998, cette maladie est recensée dans de plus en plus de pays sur le continent : en France dès 2012, en Italie en 2015, puis en Suède en 2017 à la suite d’ une importation d’esturgeon sibériens. Plus récemment, elle a également été décrite en Pologne. Au moins deux espèces virales apparentées sont présentes en Europe : le Namao virus (NV) identifié dans au moins deux pays méditerranéens chez des esturgeons adriatiques (A. naccari) et l’AcIV-E identifié sur plusieurs espèces-clés en aquaculture : les esturgeons Sibériens, Russes, perses, étoilés et sterlets (A. gueldenstaedtii, A. baerii, A. persicus, A. stellatus et A. ruthenus). La souche de Namao virus identifiée en Europe provient probablement du continent Américain, le virus étant endémique dans les populations sauvages d’Esturgeon de lac (A. fulvescens) au Canada.
Figure 1. Juvéniles d’esturgeons sibériens affectés par la mimivirose (source L. Bigarré - Anses).
En ce qui concerne l’AcIV-E, deux lignées génétiques semblent exister au vu des données de séquençage. Ces lignées peuvent être trouvées individuellement sur des poissons, mais elles peuvent co-exister chez certains individus, à des ratios variables toutefois. Des résultats obtenus à partir de virus d’Ukraine et tout juste publiés (Rud et al. 2020) suggèrent fortement l’existence de recombinaisons entre les deux lignées virales, ce qui créerait davantage de diversité génétique chez ces virus avec un risque accru d’adaptation à des nouveaux environnements. Les transferts commerciaux de poissons (intra-Europe et inter-continentaux), ainsi que les élevages multi-espèces, sont une source importante de dissémination de ces virus qui constituent un risque sanitaire croissant, non seulement pour l’activité de production de caviar, mais aussi pour la faune sauvage et les quelques élevages qui ont une activité de repeuplement des espaces naturels.
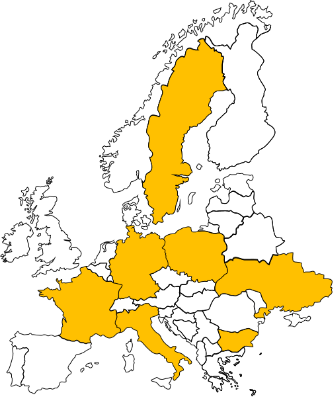
Figure 2. Carte indiquant les pays Européens pour lesquels la présence de mimivirose (orange) est démontrée (source des données?).
Virus de l’anémie infectieuse du saumon (ISAV)
La Norvège a annoncé la présence de l’ISAV sur quatorze nouveaux sites en 2018 et le même nombre en 2017 (programme de surveillance de l’ISAV par le Norvegian veterinary institute – NVI). Depuis début 2020, 18 nouveaux sites avec des cas ont été détectés d’après le NVI (source : commission européenne ADNS au 16/09/2020). Pour certains sites où l’origine du virus n’est pas élucidée, il est possible que le virus soit originaire de formes sauvages avirulentes, dites "non délétées", et capables de muter en formes virulentes .
Par ailleurs, cet été, le virus ISAV a été trouvé sur trois sites d’élevage de saumon au Canada dans la région de Terre-Neuve, tous trois appartenant à la compagnie privée Cooke (source: fishfarming expert). L’un des sites est très proche de St-Pierre-et-Miquelon. La compagnie a dû, à titre préventif, abattre 1,2 million de saumons pour éviter la propagation du virus. La compagnie émet l’hypothèse que le virus a été introduit par la faune sauvage.
Référence
Rud et al. 2020 “First genetic characterization of sturgeon mimiviruses in Ukraine”. Journal of Fish Diseases. 00:1-10 https://doi.org/10.1111/jfd.13239